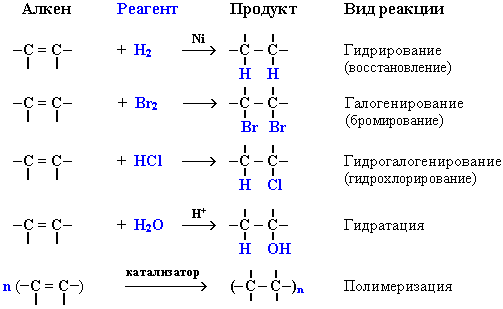
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:

Еще легче происходит присоединение хлора:

Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500°С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
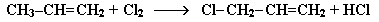
Гидрогалогенирование (присоединение галогеноводородов)

Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).

Пример (6345 байт).
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:

Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическоеобоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции идут против правила Марковникова.
Гидратация (присоединение воды)

Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения:

В реакциях несимметричных алкенов соблюдается правило Марковникова.

Реакции окисления алкенов
Строение продуктов окисления алкенов зависит
от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакцияВагнера):

Полное уравнение реакции:

(см. схему электронного баланса этой реакции).
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:

3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:

4. Полное окисление (горение):

Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Эффект Караша (эффект Хараша, перекисный эффект) — обращение региоселективности при присоединении галогеноводородов к алкенам в присутствии кислородаили перекисей. Данный эффект, впервые описанный М. Карашем и Ф. Майо в 1933 году[1], заключается в образовании аномального продукта, формально не соответствующего правилу Марковникова. Это связывают с изменением механизма реакции, которая в данном случае протекает не как электрофильное присоединение, а как радикальное присоединение[2].

Присоединение галогеноводородов к несимметричным алкенам в присутствии перекиси протекает по радикальному механизму. На стадии инициирования радикал R, полученный в результате разложения пероксидного катализатора, отщепляет от галогеноводорода атом водорода с образованием атома галогена, который на второй стадии присоединяется к двойной С=С-связи с образованием двух изомерных алкильных радикалов. Преобладающим является более замещённый, более устойчивый радикал, который затем реагирует с галогеноводородом, давая продукт — алкилгалогенид и атом галогена, продолжающий цепную радикальную реакцию[3].

Реакция катализируется перекисями, однако их добавление извне необязательно, поскольку в присутствии кислорода алкены могут сами окисляться с образованием перекисей[4]. Наряду с радикальной реакцией происходит также классическое электрофильное присоединение, однако радикальная реакция имеет гораздо более высокую скорость, за счёт чего аномальный продукт образуется в преобладающем количестве[4].
Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:

Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:

Подробнее процесс полимеризации и понятие о полимерах, имеющих исключительно важное практическое значение, рассматриваются в части VI "Высокомолекулярные соединения".
2. Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
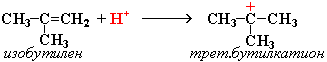
Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":
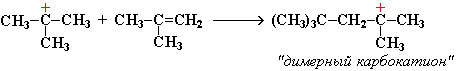
"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):
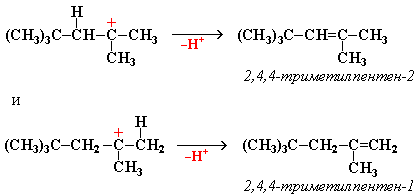
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
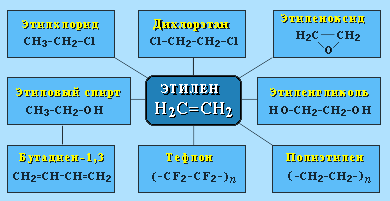
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.
Алкены вступают в разнообразные реакции присоединения.
Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Характеристики углерод-углеродных связей:

| Е+ (энергия двойной связи) С=С ( +) | 620 кДж/моль |
| Е (энергия -связи) С-С | 348 кДж/моль |
| Отсюда Е (энергия -связи) | 272 кДж/моль, |
| т.е. Е на 76 кДж/моль меньше Е. |
Поэтому для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной -связи. При этом -связь (в исходном алкене) преобразуется в -связь в продукте реакции. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения.
По какому механизму идут реакции присоединения к алкенам?
1. За счет электронов -связи в молекулах алкенов имеется область повышенной электронной плотности (облако -электронов над и под плоскостью молекулы):

Поэтому двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв связей и реакция пойдет по ионному механизму как электрофильное присоединение.
Механизм электрофильного присоединения обозначается символом АЕ
(по первым буквам английских терминов: A – addition [присоединение],
Е - electrophile [электрофил]).
2. С другой стороны, углерод-углеродная -связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму.
Механизм радикального присоединения обозначается символом АR
(R – radical - радикал).
Механизм присоединения зависит от условий проведения реакции.
Кроме того, алкенам свойственны реакции изомеризации и окисления (в том числе реакция горения, характерная для всех углеводородов).
Для алкенов, у которых двойная связь не сопряжена с ароматическим кольцом, характерно анти -присоединение галогеноводорода. Анти -присоединение хлористого и бромистого водорода, хлористого и бромистого дейтерия наблюдается для циклогексена, циклопентена, 1,2-диметилгексена, 1,2-диметилпентена, цис - и транс -бутена-2, гексена-3 и многих других простых алкенов и циклоалкенов.

В продукте присоединения одинаковые заместители (метильные группы) расположены по разные стороны средней плоскости циклогексанового кольца, следовательно он относится к транс -ряду. Анти -присоединение трудно совместимо с механизмом, в котором предполагается образование дискретного карбокатиона. Для плоского карбокатиона нуклеофильная атака галогенид-иона равновероятна с обеих сторон плоскости, что должно привести к образованию смеси продуктов син - и анти -присоединения. Кинетика гидрогалогенирования алкенов также указывает на более сложный механизм присоединения. Для несопряженных алкенов скорость реакции описывается уравнением третьего порядка со вторым порядком по галогеноводороду, т. е. соответствует AdE3-механизму.
v = k [алкен][HX]2
Анти -присоединение и второй порядок реакции по галогеноводороду хорошо согласуется с AdE3-механизмом, в котором алкен взаимодействует с двумя молекулами галогеноводорода, одна из которых выполняет функцию электрофильного, а другая - нуклеофильного агента.

Альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:

В зависимости от типа заместителя Х эти соединения подразделяют на:
альдегиды (Х = Н);
кетоны (Х = R, R');
карбоновые кислоты (Х = ОН)
и их производные (Х = ОR, NH2, NHR, Hal и т.д.).
Альдегиды - органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
Общая формула: R–CН=O или

| R = H, алкил, арил |
Функциональная группа –СН=О называется альдегидной.
Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Общие формулы: R2C=O, R–CO–R' или

| R, R' = алкил, арил |
Примеры:

| Модели простейших карбонильных соединений | ||
| Название | Формула | Модель |
| Формальдегид (метаналь) | H2C=O | 
|
| Ацетальдегид (этаналь) | СH3-CH=O | 
|
| Ацетон (пропанон) | (СH3)2C=O | 
|






