Первичные спирты окисляются до карбоновых кислот реагентом Джонса или перманганатом калия в кислой или щелочной среде.


Окисление альдегидов.
Для окисления альдегидов используют те же реагенты, а также оксид серебра.

Окисление алкилбензолов.
В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д.
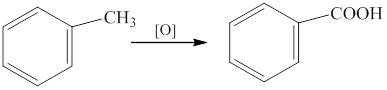
Галоформная реакция метилкетонов.
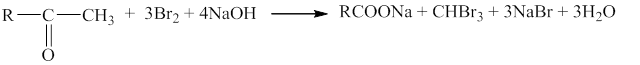
Гидролиз нитрилов.
Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:

Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.).
Все функциональные производные карбоновых кислот при гидролизе в кислой или щелочной среде образуют карбоновые кислоты или их соли.

Гидролиз тригалогенопроизводных.
Тригалогенопроизводные гидролизуются в соответствующие карбоновые кислоты.

Химические свойства.
Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.

Величины валентных углов, близкие к 1200, и плоский характер карбоксильной группы указывают на sp 2-характер гибридизации углерода карбоксильной группы.
В молекулах карбоновых кислот можно выделить ряд реакционных центров:

· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
· электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
· основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения;
· СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+).
Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.








