Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7.
| [O] | [O] | |||
| R-CH2-OH | → | R-CH=O | → | R-CO-OH |
| Спирт | альдегид | кислота |
2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
| ЗNаОН | ||||
| R-CCl3 | → | [R-C(OH)3] | → | R-COOH + Н2О |
| -3NaCl |
3. Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН + NH4Cl.
4. Использование реактива Гриньяра по схеме:
Н2О
R-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br
5. Гидролиз сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH,
R-COOK + HCl → R-COOH + KCl.
6. Гидролиз ангидридов кислот:
(RCO)2O + Н2О → 2RCOOH.
7. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
| 200 °С, Р | H2SO4 | |||
| NaOH + СО | → | HCOONa | → | НСООН |
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 = 5С6Н5СООН + 3K2SO4 + 6MnSO4 + 14H2O.
Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40—60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и соответственно фенилметанола (бензилового спирта):
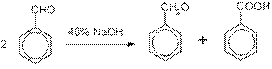
Химические свойства. Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют:
RCOOH  RCOO- + Н+
RCOO- + Н+
Тем не менее из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточносильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например, этановая (уксусная) кислота характеризуется константой диссоциации Ка = 1,7*10-5.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в значениях констант диссоциации Ka для ряда кислот. Кроме того, на силу кислоты оказывает влияние наличие сопряженной кратной связи.
| Карбоновые кислоты Формула Ka |
| Пропионовая CH3CH2COOH 1,3*10-5 |
| Масляная CH3CH2CH2COOH 1,5*10-5 |
| Уксусная CH3COOH 1,7*10-5 |
| Кротоновая CH3-CH=CH-COOH 2,0*10-5 |
| Винилуксусная CH2=CH-CH2COOH 3,8*10-5 |
| Акриловая CH2=CH-COOH 5,6*10-5 |
| Муравьиная HCOOH 6,1*10-4 |
| Бензойная C6H5COOH 1,4*10-4 |
| Хлоруксусная CH2ClCOOH 2,2*10-3 |
| Тетроновая CH3-C≡C-COOH 1,3*10-3 |
| Дихлоруксусная CHCl2COOH 5,6*10-2 |
| Щавелевая HOOC-COOH 5,9*10-2 |
| Трихлоруксусная CCl3COOH 2,2*10-1 |
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК + Н2О  СН3СООН + КОН.
СН3СООН + КОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
3. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R—CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
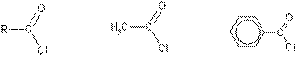
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
R-CO-OH + РСl 5 → R-CO-Cl + РОСl3 + HCl.
| Соединение примеры |
Кислота
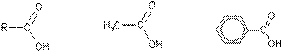 Этановая(уксусная) Бензойная кислота
хлорангидрит кислоты
Этановая(уксусная) Бензойная кислота
хлорангидрит кислоты
 Этаноилхлорид Бензоилхлорид
(ацетилхлорид)
ангидрид кислоты
Этаноилхлорид Бензоилхлорид
(ацетилхлорид)
ангидрид кислоты
 Этановый(уксусный) бензойный ангидрит
ангидрит
сложый эфир
Этановый(уксусный) бензойный ангидрит
ангидрит
сложый эфир
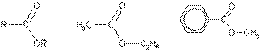 Этилэтаноат(этилацетат) Метилбензоат
амид
Этилэтаноат(этилацетат) Метилбензоат
амид
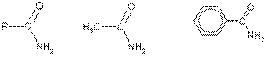 Этанамид(ацетамид) Бензамид
Нитрил
Этанамид(ацетамид) Бензамид
Нитрил
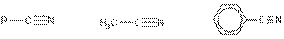 Этаннитрил Бензонитрил
(ацетонитрил)
Этаннитрил Бензонитрил
(ацетонитрил)
|
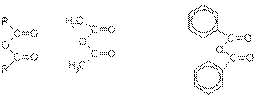
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-CO-OH + Р2О5 → (R-CO-)2O + 2НРО3.
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
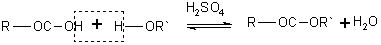
Механизм реакции этерификации был установлен методом "меченых атомов".
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-CO-Cl + Na-O-R' → R-CO-OR' + NaCl.
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
СН3-СО-Сl + CН3 → СН3-СО-CН2 + HCl.
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот:
| t° | ||
| CH3-COONH4 | → | CH3-CO-NH2 + Н2О |
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
| Р205 | ||
| CH3-CO-NH2 | → | CH3-C≡N + Н2О |
Функциональные производные низших кислот - летучие жидкости. Все они легко гидролизуются с образованием исходной кислоты:
R-CO-X + Н2О →R-CO-OH + НХ.
В кислой среде эти реакции могут быть обратимы. Гидролиз в щелочной среде необратим и приводит к образованию солей карбоновых кислот, например:
R-CO-OR' + NaOH → R-CO-ONa + R'OH.
4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (а-атоме):
| ркр | ||
| СН3-СН2-СООН + Вr2 | → | СН3-СНВr-СООН + НВr |
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН-СООН + Н2 → СН3-СН2-СООН,
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН,
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН,
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН,
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
5. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
| 2[Н] | ||
| СН3СООН | → | СН3СНО + Н2О |
| 4[Н] | ||
| СН3СООН | → | СН3СН2ОН + Н2О |
| 6[Н] | ||
| СН3СООН | → | С2Н6 + 2Н20 |
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
| Н2SО4(конц) | ||
| НСООН | → | СО + Н2О |
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
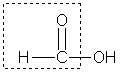
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию "серебряного зеркала":
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O,
или в упрощенном виде:
CН3 НСООН + Аg2О → 2Аg + СО2 + Н2О.
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
6. Реакции декарбоксширования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С—С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
| t° | ||
| CH3-CH2-COONa + NaOH | → | С2Н6↑ + Na2CO3 |
Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования:
| 70°C | ||
| ССl3СООН | → | CHCl3↑ + СО2↑ |
Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании:
| t° | ||
| НООС-СН2-СООН | → | СН3СООН + CO2↑ |
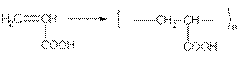
Физические свойства. Насыщенные алифатические монокар-боновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1 COOH. Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный "уксусный" запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название "ледяная" уксусная кислота. Средние представители этого гомологического ряда — вязкие, "маслообразные" жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
Физические свойства карбоновых кислот
| Название кислоты | Химическая формула | tпл | tкип | Чсло Двойных Связей |
| Муравьиная(метановая) | HCOOH | |||
| Уксусная(этановая) | CH3COOH | |||
| Пропионовая(пропановая) | CH3CH2COOH | -22 | ||
| Акриловая(пропеновая) | CH2=CH-COOH | |||
| Капроновая(гексановая) | CH3(CH2)4COOH | -2 | ||
| Пальмитиновая (гексадециловая) | C15H31COOH | |||
| Стеариновая(октадециловая) | C17H35COOH | |||
| Олеиновая (цис-октадецен-9-овая) | C17H33COOH | |||
| Линолевая (октадекадиен-9,12-овая) | C17H31COOH | -5 | ||
| Линоленовая(октадекатриен-9,12,15-овая) | C17H29COOH | -11 | ||
| Бензойная(бензолкарбоновая) | C6H5COOH | |||
| Щавелевая(этандиовая) | HOOC-COOH |
При одной и той же длине углеводородного радикала температуры плавления (и кипения) зависят от наличия кратных связей — с ростом их числа соответствующие температуры уменьшаются.
Ненасыщенные кислоты при комнатной температуре являются, как правило, жидкостями.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
Механизм реакции[править | править исходный текст]
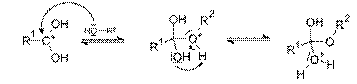
Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированного карбкатиона:

после чего происходит нуклеофильная атака атома кислорода гидроксильной группы спирта на карбониевый центр с образованием алкилоксониевого иона, эта стадия является лимитирующей. Затем в алкилоксониевом ионе происходит миграция протона на один из гидроксилов с образованием уходящей группы —O+H2:
Завершающей стадией является отщепление промежуточного продукта присоединения воды и протона — катализатора с образованием сложного эфира:
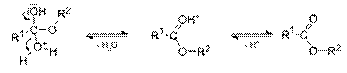
Механизм реакции подтвержден экспериментом с использованием изотопных меток: при использовании спирта, меченного изотопом 18O, метка оказывается в составе сложного эфира: 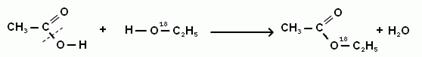
Высшие жирные кислоты совершенно нерастворимы в воде и поэтому не имеют кислого и вообще никакого вкуса. Но в спиртовом растворе они могут быть оттитрованы едкой щелочью и дают четкий переход окраски с лакмусом, фенолфталеином и другими индикаторами. Они легко растворяются в водных растворах едких щелочей и карбонатов щелочных металлов (вытесняя угольную кислоту) с образованием солей. Соли высших жирных кислот называются мылами; мыла имеют весьма важное практическое значение не только для мытья и стирки, но также в технике для промывания шерсти, отделки тканей и пр. Для этих целей применяются преимущественно натриевые (твердые) мыла. Как антисептическое средство в медицине применяется калийное жидкое («зеленое») мыло. В технике имеют применение также жидкие натриевые и аммониевые мыла олеиновой кислоты. Растворы мыл отличаются весьма своеобразными физико-химическими свойствами. Тогда как разбавленные растворы, особенно спиртовые, имеют свойства истинных, или молекулярных, растворов, концентрированные водные растворы уже обладают всеми свойствами коллоидных систем, в том числе способностью коагулировать, или «высаливаться», при добавлении электролитов, например поваренной соли. Обыкновенные продажные мыла представляют собой коллоидные системы, содержащие большое количество воды, а часто также и примеси других минеральных и органических солей. Чистые мыла легко выделяются из растворов в кристаллическом виде. Из практически применяемых мыл наименьшее количество примесей содержит так называемое «ядровое» мыло, получаемое «высаливанием» раствора, образовавшегося при омылении жиров, с последующим «увариванием на ядро», т. е. до получения однородной густой массы, твердеющей при охлаждении. «Клеевые» мыла готовят таким образом, что раствору мыла со всеми примесями дают застыть в твердую студнеобразную массу. Очень часто ее «наполняют», т. е. прибавляют различные вещества (например, глину, растворимое стекло и пр.). Моющее действие мыл является сложным физико-химическим процессом, исчерпывающее объяснение которого связано с значительными трудностями. Во всяком случае высказываемое иногда мнение, что моющее действие мыл связано с гидролизом их водных растворов, сопровождающимся образованием свободных щелочей, неправильно. Моющее действие мыльных растворов заключается в эмульгировании жиров и масел и суспендировании мельчайших твердых частичек грязи. Очевидно, что моющее действие будет тем сильнее выражено, чем выше стойкость образующихся эмульсий или суспензий. Стойкость эмульсий зависит главным образом от величины поверхностного натяжения на границе масла и водного мыльного раствора. Вещества, адсорбирующиеся на поверхностях раздела двух жидкостей, понижают поверхностное натяжение и способствуют стабилизации эмульсий (и суспензий). На рис. 16 показано, как изменяется относительное поверхностное натяжение (за единицу принято поверхностное натяжение воды) на границе между маслом и водными растворами натриевых солей нескольких жирных кислот. Опыт показывает, что стойкие эмульсии жиров образуются с водными растворами монокарбоновых кислот, начиная от лауриновой кислоты (С12); она же является первой жирной кислотой, натриевая соль которой обладает хорошим моющим действием. Моющее действие зависит также от концентрации мыльных растворов, обычно достигая максимума при определенной концентрации (например, для олеата натрия при концентрации 0,4%), от щелочности среды (обычно лучшие результаты получаются при рН=9—11) и от температуры. Для большинства мыл благо приятнее более низкая температура. Возможно, что это связано с изменением характера мыльных растворов: при низких температурах образуются коллоидные системы, переходящие при высоких температурах в истинные растворы (исчезновение опалесценции при нагревании).
Гидроксислоты. Оптическая озомерия на основе гидрокислот.






