Карбоновыми кислотами называются соединения, содержащие карбоксильную группу cooh
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа -СООН), дикарбоновые, или двухосновные (две группы -СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая). В таблице указаны некоторые представители карбоновых кислот.
| Формула | Систематическое Название | Тривиальное Название |
| Монокарбоновые кислоты | ||
| HCOOH | метановая | муравьиная |
| CH3COOH | этановая | уксусная |
| C2H5COOH | пропановая | пропионовая |
| C6H5COOH | бензойная | - |
| CH3(CH2)16COOH | октадециловая | стеариновая |
| CH2=CH-COOH | пропеновая | акриловая |
| Дикарбоновые кислоты | ||
| HOOC-COOH | этандиовая | щавелевая |
| HOOC-CH2-COOH | пропандиовая | малоновая |
| HOOC-CH2CH2-COOH | бутандиовая | янтарная |
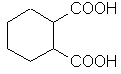
| бензол-1,2- дикарбоновая | фталевая |

| бензол-1,4- дикарбоновая | терефталевая |
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название "жирные" эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О-Н ослабляется:
В свою очередь, группа ОН "гасит" положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Номенклатур а. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
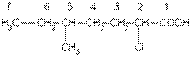
2-хлор-5-метилгептановая кислота
CH3—CH=CH—COOH
бутен-2-овая кислота
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание "карбоновая кислота" и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
9 8
СН3(СН2)7СН=СН(СН2)7СООН
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса "диовая" и слова "кислота". Например, этандиовая (щавелевая) кислота (НООС-СООН).

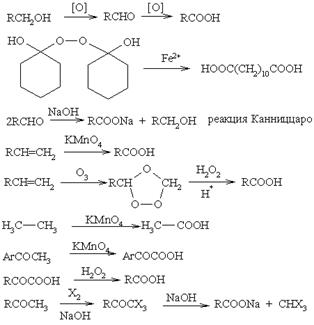
| Общепринятым методом синтеза карбоновых кислот является окиcление первичных спиртов или альдегидов. Однако прямое окисление первичных спиртов хромовой кислотой зачастую дает плохие выходы [2], так как и образующегося в качестве промежуточного соединения альдегида и не прореагировавшего спирта может получиться полуацеталь, который очень быстро окисляется в эфир. Прямое окисление пероксидом никеля осуществляется без подобных осложнений. Однако при окислении алифатических спиртов наблюдается падение выхода при уменьшении их растворимости в воде. Следовательно, во многих случай более предпочтительно окисление хлорохроматом пиридиния в альдегиды, а затем перманганатом калия в присутствии катализатора межфазного переноса или оксидом хрома (VI) в кислоты. Аллиловые спирты очень легко окисляются оксидом серебра (II) в присутствии цианид-ионов в a,b-ненасыщенные карбоновые кислоты. С хорошими выходами осуществляется озонолиз циклических ацеталей в эфиры карбоновых кислот.
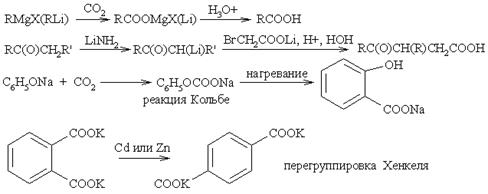
Окисление метил- или алкилароматических соединений, содержщих a-Н (PhCHR2 –> PhCOOH), перманганатом калия в щелочной среде позволяет получать ароматические карбоновые кислоты. С этим способом сравнимо радикальное хлорирование метилароматических соединений в трихлорметилароматические производные с последующим их гидролизом (PhCH3 –> PhCCl3 –> PhCOOH). В синтезе карбоновых кислот большое значение приобрели методы введения карбоксильной группы в качестве С1-единицы при взаимодействии металлоорганических соединений (например, реактив Гриньяра) с твердым диоксидом углерода и замещение галогеналканов цианидом натрия с образованием нитрилов и последующим их гидролизом. С хорошим выходом протекает и карбоксилирование метилмагнийкарбонатом СН-кислотных кетонов в a-положение с образованием b-кетокарбоновых кислот (осторожно! при выделении продукты легко декарбоксилируются!). Интересным вариантом является прямое карбоксилирование трианионов 2,4,6-трикетосоединений в положение 1 с образованием поли-b-кетокислот.
Кетоны и олефины можно превратить в карбоновые кислоты путем расщепления С–С-связи. Так, например, окисление циклогексанона перманганатом калия дает адипиновую кислоту. Окислением циклических олефинов перманганатом калия в присутствии катализатора межфазного переноса при определенных условиях можно получить 1,2-диолы илиa,w-биальдегиды. Если кетоны вводят в реакцию с надкислотами, то в результате перегруппировки получают эфиры карбоновых кислот (окисление по Байеру-Виллигеру). При взаимодействии метилкетонов с галогенами (Х2) в щелочной с отщеплением метильной группы (в виде СНХ3) образуются соответствующие карбоновые кислоты (галоформная реакция). В качестве промежуточного соединения образуется a-тригалогенметил кетон (R–СО–СН3 –> R–СО–СХ3 –> R–COOН + СНХ3).
Арилкетоны, вступая в реакцию с морфолинполисульфидом с пoследующим гидролизом, дают фенилалкил-w-карбоновые кислоты с сохранением углеродного скелета. Особенно элегантно протекает превращение алкиларилкетонов в производное арилуксусной кислоты под действием нитрата таллия (III) на носителе.
В щелочной среде 1,2-дикетоны подвергаются бензильной перегруппировке (R–CO–CO–R –> RRC(OH)–COOH). Синтетический интерес представляет также превращение в монооксим с последующей перегруппировкой по Бекману.
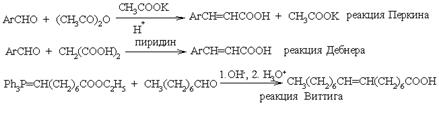
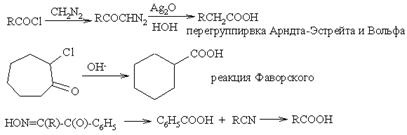
Расщепление 1,3-дикарбоновых соединений и перегруппировка Фаворского также пригодны для синтеза карбоновых кислот. Постоянно возрастает и количество гетероциклов, привлекаемых для синтеза (в особенности для энантиоселективного) замещенных карбоновых кислот.
Кроме того, карбоновые кислоты получают гидролизом хлорангидридов и ангидридов кислот, сложных эфиров и амидов. Но сами эти соединения чаще всего получают из карбоновых кислот. Синтетическое значение имеет ферментативный гидролиз диэфиров мезомерных дикарбоновых кислот с образованием энантиомерно чистых соединений (например, с использованием эстеразы из свиной печени).
Гидролиз
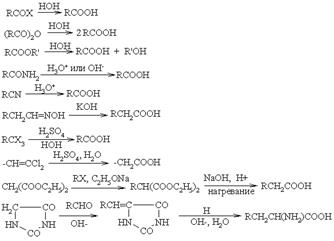 Окисление
Окисление
 Карбоксилирование и карбоксиметилирование металлорганических соединений
Карбоксилирование и карбоксиметилирование металлорганических соединений
 Конденсация
Конденсация
 Щелочное расщепление
Щелочное расщепление
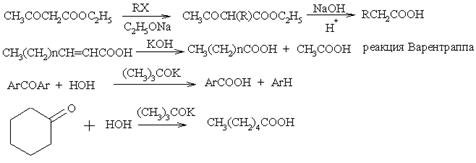 Замещение и присоединение
Замещение и присоединение
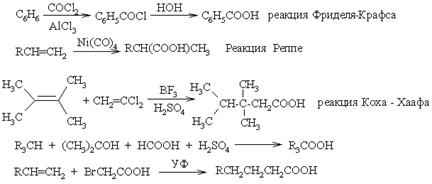 Перегруппировки
Перегруппировки
|
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания "дикарбоновая кислота". Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
Оптическая изомерия, в которой изомеры имеют совершенно одинаковые физические и химические свойства, поворачивают плоскость поляризации света на равный угол, но (!) в противоположных направлениях. Так, например, 2-оксипропановая (молочная) кислота имеет два изомера:

Такие изомеры являются зеркальным отражением друг друга и при вращении молекулы не могут быть совмещены. Необходимо обратить внимание на то, что центральный атом углерода в этих молекулах окружен четырьмя разными заместителями. Такой атом углерода называется асимметрическим, и наличие его в молекуле является непременным признаком того, что для этой молекулы существует оптический изомер.
___
Оптические изомеры
Еще один вид изомерии возникает в том случае, когда в молекуле имеется хиральный центр или молекула в целом является хиральной. Хиральность (от греч. cheir - рука) служит причиной образования структур, которые нельзя совместить, поскольку они являются зеркальными изображениями друг друга (зеркальная изомерия). Наиболее частая причина хиральных свойств - присутствие асимметрического атома углерода, т. е. атома с четырьмя различными заместителями. В этом случае образуются две формы (энантиомеры) с различной конфигурацией. Чаще всего энантиомеры носят название L- и D-формы. Для указания абсолютной конфигурации асимметрического атома пользуются R/S-номенклатурой.
Энантиомеры имеют очень близкие химические свойства. Основное различие между ними состоит в том, что они вращают плоскость поляризованного света в противоположных направлениях. Это справедливо и в отношении молочной кислоты. Правовращающая L-молочная кислота встречается в мышцах и крови животных, а продуцируемая микроорганизмами D-форма может быть обнаружена, например, в молочных продуктах. Соединения, имеющие хиральные центры, часто изображают с помощью фишеровских проекций.
ИЗОМЕРИЯ ОКСИКИСЛОТ2. Изомерия углеродного скелета СН3СН3− С−СООН α−оксиизомасляная кислота ОН СН3ОН−СН3−СН−СООН β −оксиизомасляная кислота3. Оптическая изомерия – изомерия, связанная сналичием асимметрических атомов углерода.






