Общая формула альдегидов 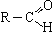 или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой. Кетоны - органические вещества, молекулы которых содержат карбонильную группу —
или R—CHO. Функциональная группа альдегидов (—CHO) называется альдегидной группой. Кетоны - органические вещества, молекулы которых содержат карбонильную группу —  —, связанную с двумя углеводородными радикалами. Общая формула кетонов
—, связанную с двумя углеводородными радикалами. Общая формула кетонов  или R—CO—R'.
или R—CO—R'.
Альдегиды и кетоны называются карбонильными соединениями, их общая формула - CnH2nO.
Изомеры и гомологи
| г о м о л о г и | HCHO метаналь (формальдегид, муравьиный альдегид) | |
| CH3CHO этаналь (ацетальдегид, уксусный альдегид) | ||
| CH3CH2CHO пропаналь (пропионовый альдегид) | CH3—CO—CH3 пропанон (ацетон) | |
| CH3CH2CH2CHO бутаналь (масляный альдегид) |  2-метилпропаналь 2-метилпропаналь
| CH3—CO—CH2CH3 бутанон (метилэтилкетон) |
| и з о м е р ы |
В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей.
Алгоритм составления названий альдегидов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -аль.
Физические свойства: формальдегид - газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид - бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон - бесцветная жидкость с резким запахом, растворим в воде.
В ряду алканы  альдегиды (кетоны)
альдегиды (кетоны)  спирты растворимость в воде и температура кипения увеличивается.
спирты растворимость в воде и температура кипения увеличивается.
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь 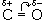 поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд ( +) на атоме углерода этой группы, тем выше активность соединения.
+) на атоме углерода этой группы, тем выше активность соединения.
Горение:
2CH3CHO + 5O2 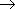 4CO2 + 4H2O
4CO2 + 4H2O
2CH3COCH3 + 9O2 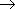 6CO2 + 6H2O
6CO2 + 6H2O
Присоединение (по двойной связи карбонильной группы).
В ряду HCHO 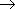 RCHO
RCHO 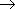 RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):
HCHO + H2 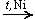 CH3OH
CH3OH
CH3—CO—CH3 + H2 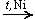 CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные.
Окисление:
CH3CHO + Ag2O  2Ag
2Ag  + CH3COOH (реакция "серебряного зеркала" - качественная реакция)
+ CH3COOH (реакция "серебряного зеркала" - качественная реакция)
HCHO + 2Cu(OH)2  2H2O + Cu2O
2H2O + Cu2O  + HCOOH (образуется красный осадок - качественная реакция)
+ HCOOH (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются.
Замещение атомов водорода в углеводородном радикале (замещение происходит в  -положение, т. е. замещается атом водорода у 2-го атома углерода):
-положение, т. е. замещается атом водорода у 2-го атома углерода):
2( ) )
| |||
| CH3 | —CH2 | —CHO | + Cl2  CH3—CHCl—CHO + HCl CH3—CHCl—CHO + HCl
|
Получение альдегидов и кетонов
Окисление спиртов.
а) Первичных
CH3OH + CuO  HCHO + Cu + H2O
HCHO + Cu + H2O
б) Вторичных
CH3—CH(OH)—CH3 + [O] 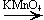 CH3—CO—CH3 + H2O
CH3—CO—CH3 + H2O
Дегидрирование спиртов.
а) Первичных
CH3CH2OH 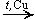 CH3CHO + H2
CH3CHO + H2
б) Вторичных
CH3—CH(OH)—CH3 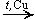 CH3—CO—CH3 + H2
CH3—CO—CH3 + H2
Окисление метана: CH4 + O2 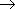 HCHO + H2O (При 500oС в присутствии оксидов азота)
HCHO + H2O (При 500oС в присутствии оксидов азота)
Гидратация ацетилена (реакция Кучерова; лабораторный способ): C2H2 + H2O  CH3CHO
CH3CHO
Окисление этилена: 2C2H4 + O2 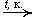 2CH3CHO
2CH3CHO
Классификация альдегидов и кетонов:
 В зависимости от строения УВ радикала альдегиды и кетоны бывают алифатическими (предельными и непредельными) и ароматическими.
В зависимости от строения УВ радикала альдегиды и кетоны бывают алифатическими (предельными и непредельными) и ароматическими.






