Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные (замещен один атом водорода),вторичные (замещены два атома водорода из трех) и третичные (замещены три атома водорода из трех) амины.Четвертичное аммониевое соединение вида [R4N]+Cl- является органическим аналогом аммониевой соли.
По характеру органической группы, связанной с азотом, различают алифатические CH3-N<, ароматические C6H5-N< и жирно-ароматические (содержат ароматический и алифатический радикалы) амины.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
Номенклатура[править | править исходный текст]
К названию органических остатков, связанных с азотом, добавляют слово «амин» при этом группы упоминают в алфавитном порядке: CH3NHC3H7 — метилпропиламин, CH3N(C6H5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
 2-аминопентан
2-аминопентан
Для некоторых аминов используются тривиальные названия: C6H5NH2 — анилин (систематическое название —фениламин).
Химические свойства[править | править исходный текст]
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
Алкиламины являются сильными основаниями, ариламины менее основны.
Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
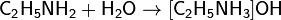
Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:

Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:
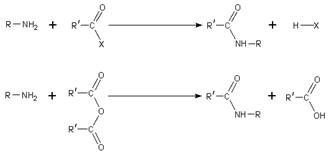
Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Таким образом получают жаропонижающее средство — ацетанилид:
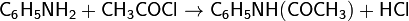
Если в качестве исходных соединений взять диамин и дикарбоновую кислоту, то они взаимодействуют по такой же схеме, но поскольку каждое соединение содержит две реагирующие группы, то образуется полиамид.
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
Ароматические амины реагируют с галогенами по механизму электрофильного замещения в бензольном ядре. При галогенировании анилина бромной водой при комнатной температуре образуется триброманилин (в виде осадка белого цвета):

Если нет реакционноспособных групп в радикале, то образуются N-галогенамины.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощиазотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:

При этом выделяется газ (азот). Это признак того, что в колбе первичный амин. Вторичные амины образуют сазотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:

Вторичные амины сложно не узнать: по лаборатории распространяется характерный запах нитрозодиметиламина.
Третичные амины при обычной температуре в азотистой кислоте просто растворяются. При нагревании возможна реакция с отщеплением алкильных радикалов.
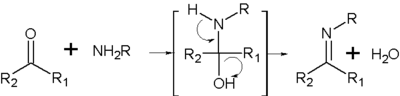
конденсация первичных аминов с альдегидами и кетонами приводит к образованию иминов или так называемых оснований Шиффа — соединений, содержащих фрагмент -N=C<:
При горении амин выделяет кроме воды и углекислого газа ещё и азот:

Получение[править | править исходный текст]
Восстановление нитросоединений — Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:

Восстановление железом:

Восстановление водородом в присутствии катализатора и при высокой температуре:

Также возможно получение путем восстановления нитрилов, оксимов, амидов, путем алкилирования аммиака(реакция Гофмана), путем перегруппировки бензильных четвертичных аммониевых солей (реакция Соммле-Хаузера), путем перегруппировки гидроксамовых кислот (перегруппировка Лоссена).
Некоторые наиболее известные амины[править | править исходный текст]
| Метиламин Диметиламин Триметиламин Диэтиламин Триэтиламин Пропиламин Этилендиамин | Анилин Пропилендиамин N-Метиланилин N,N-Диметиланилин N-Этиланилин N,N-Диэтиланилин Пиперидин | Пиридин 2-Пиколин 1,1,3,3-Тетраметилгуанидин Хинолин Морфолин N-Метил-2-пиролидон Трибензиламин |
Нитрозосоединения
Канцерогенные нитрозосоединения могут поступать в продукты из загрязненной окружающей среды, в небольших количествах они содержатся в копченом, вяленом, консервированном мясе и рыбе, темных сортах пива, сухой и соленой рыбе, маринованных и соленых овощах. Однако главным является загрязнение пищи предшественниками нитрозосоединений: нитратами и нитритами. В результате современных агрохимических мероприятий, использования минеральных удобрений, овощи и другие растительные продукты содержат довольно много нитратов. Сами по себе нитраты безопасны. Опасность заключается в том, что около 5% нитратов восстанавливается в пище или в организме до нитритов, которые, в свою очередь, являются предшественниками канцерогенных нитрозосоединений. Другие предшественники нитрозосоединений — амины и амиды — обнаружены в разнообразных пищевых продуктах. В результате нитрозирования нитритами аминов и амидов возникают канцерогенные нитрозосоединения (нитрозамины и ни- трозамиды). Синтез канцерогенных нитрозосоединений из предшественников самопроизвольно идет в продуктах при комнатной температуре. Обработка продуктов коптильным дымом, обжаривание, консервирование и засолка резко ускоряют образование в них канцерогенных нитрозосоединений. В противоположность этому, хранение продуктов при низких температурах в холодильниках резко тормозит их образование. Синтез канцерогенных нитрозаминов и нитрозамидов из пищевых предшественников происходит и в самом организме: желудке, кишечнике и мочевом пузыре. В исследовании добровольцам давали овощной сок с высоким содержанием нитратов, после чего у них в моче обнаруживали большое количество нитрозосоединений. Канцерогенные нитрозосоединения могут вызывать у человека опухоли желудка, пищевода, печени, носовой полости, глотки, почек, мочевого пузыря, головного мозга и других органов.
Наибольшее количество нитратов содержат овощи, выращиваемые на повышенных количествах азотистых удобрений: салат, шпинат, сельдерей, ревень, редис, редька, свекла, баклажаны, картофель. Конечно, если эти овощи выращены на естественных удобрениях, то нитратов в них нет. Нитраты прекрасно переходят в воду при варке овощей. Затем, если сваренный суп или борщ стоит при комнатной температуре, то в нем быстро образуются нитриты. Морковь, свекла, картофель и другие овощи долго могут лежать при комнатной температуре и кажутся свежими, однако содержащиеся в них нитраты при этой температуре быстро превращаются в нитриты. Уже при температуре + 2°С невозможно превращение нитратов в нитриты. Именно такая температура поддерживается в камерах современных холодильников. Сейчас у каждой семьи имеются холодильники. Между тем, многие хозяйки не считают нужным быстро охладить приготовленную еду и спрятать ее в холодильник, не хранят овощи и фрукты в холодильнике, а это необходимо делать. Хорошо деревенским жителям, они могут хранить овощи в погребах и в ледниках, где поддерживается достаточно низкая температура. Городскому жителю можно лишь посоветовать не покупать овощи и фрукты, в том числе второй хлеб — картофель — в количествах, превышающих возможности его холодильника.
Нитриты очень токсичны. Высокое содержание нитритов выявляется в мясных копченостях, мясных консервах и колбасных изделиях. Это связано с применением в технологии производства этих продуктов солей азотистой кислоты. В небольших количествах нитриты содержатся в злаках, корнеплодах, безалкогольных газированных напитках. Частый путь поступления нитритов в организм — в виде пищевых добавок. Нитриты являются прекрасными консервантами и с прошлого века используются для сохранения мясных продуктов. И хотя сегодня хорошо известно об их онкологической опасности, добавки нитритов, чаще всего нитрита натрия, широко применяют при приготовлении колбас, ветчин, бекона, мясных консервов. Перечисленные продукты, содержащие нитриты, не должны быть в повседневном питании.
Азосоединения: строение, номенклатура, изомерия, получение реакцией азосочетания. Азокрасители и полихлорированные производные азо-бензола, их токсическое действие и накопление в биосфере.
Азосоединения — класс органических соединений общей формулы R1-N=N-R2, формально - производные нестойкого диазена (диимида) HN=NH, у которого оба атома водорода замещены органическими радикалами[1]. Простейшее алифатическое азосоединение — азометан Н3C—N=N—CH3; простейшее ароматическое азосоединение - азобензол C6H5—N=N—C6H5.
Ароматические азосоединения интенсивно окрашены и применяются в качестве красителей и пигментов.
Номенклатура[править | править исходный текст]
Названия азосоединений образуются в соответствии с заместительной номенклатурой, для обозначения азогруппы —N=N— в названиях используется частица -азо-. Симметричные азосоединения R—N=N—R именуются добавлением префикса азо- к названию соединения-предшественника радикала R; например, азометан если R - метил и 1,1-азонафталин в случае R = 1-нафтил. Если заместители у азогруппы различны, то название образуется из имени «старшего» заместителя, частицы -азо- и имени младшего заместителя, например, нафталин-1-азобензол.
Наиболее широко применяемым методом синтеза функционализированных ароматических азосоединений является азосочетание - реакция диазониевых солей с ароматическими соединениями, несущими электрондонорные заместители, этот метод применяется в промышленности в синтезе азокрасителей:

Как и в случаеалкенов, для азосоединений характерна геометрическая изомерия, более стабильными являются транс-изомеры, которые могут изомеризоваться в цис-форму при облучении видимым светом или ультрафиолетом с длиной волны, соответствующей области поглощения n 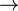 π* перехода.
π* перехода.
Возможность n 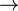 π* перехода, обусловленного наличием неподеленных электронных пар, ведет к появлению слабой (вследствие запрещенности по симметрии перехода) полосы поглощения в алифатических азосоединений в области 160-300 нм, у цис- и транс-азобензолов - при 432 и 450 нм.
π* перехода, обусловленного наличием неподеленных электронных пар, ведет к появлению слабой (вследствие запрещенности по симметрии перехода) полосы поглощения в алифатических азосоединений в области 160-300 нм, у цис- и транс-азобензолов - при 432 и 450 нм.
Электронный переход π 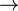 π* азогруппы ведет к появлению в УФ спектрах ароматических азосоединений интенсивной полосы при 280-320 нм, которая при введении сопряженных с азогруппой электрондонорных заместителей ведет к батохромному сдвигу и усилению поглощения азосоединения, такие соединения используются в качестве красителей.
π* азогруппы ведет к появлению в УФ спектрах ароматических азосоединений интенсивной полосы при 280-320 нм, которая при введении сопряженных с азогруппой электрондонорных заместителей ведет к батохромному сдвигу и усилению поглощения азосоединения, такие соединения используются в качестве красителей.
Для азосоединений, несущих в заместителе сопряженный с азогруппой подвижный атом водорода возможнатаутомерия азо- и гидразонной форм (азо-гидразонная таутомерия):

Азокрасители[править | править исходный текст]
Азокрасители — органические соединения, содержащие одну или несколько азогрупп, напр, конго красный,метиловый оранжевый, β-нафтолоранж и другие. Азокрасители разнообразны по цвету, как правило, не очень стойки. Азокрасители — самый многочисленный класс синтетических красителей, применяют для крашения тканей,кожи, бумаги, резины, в лакокрасочной, полиграфической и других отраслях, в аналитической химии как индикатор.






