Нитросоединения
Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают C-нитросоединения, в которых нитрогруппа связана с атомом углерода (нитроалканы, нитроалкены, нитро арены). O-нитросоединения и N-нитросоединения выделяют в отдельные классы — нитроэфиры (органические нитраты) и нитрамины.
В зависимости от радикала R, различают алифатические (предельные и непредельные), ациклические, ароматические и гетероциклические нитросоединения. По характеру углеродного атома, с которым связана нитрогруппа, нитросоединения подразделяются на первичные, вторичные и третичные.
Нитросоединения изомерны эфирам азотистой кислоты HNO2 (R-ONO)
При наличии α-атомов водорода (в случае первичных и вторичных алифатических нитросоединений) возможна таутомерия между нитросоединениями и нитроновыми кислотами (аци-формами нитросоединений):

Из галогенпроизводных:

Нитрование
Нитрование — реакция введения нитрогруппы —NO2 в молекулы органических соединений.
Реакция нитрование может протекать по электрофильному, нуклеофильному или радикальному механизму, при этом активной частицей в данных реакциях являются соответственно катион нитрония NO2+, нитрит-ион NO2- или радикал NO2•. Процесс заключается в замещении атома водорода у атомов C, N, O или присоединении нитрогруппы по кратной связи.
Электрофильное нитрование[править | править исходный текст]
При электрофильном нитровании основным нитрующим агентом является азотная кислота. Безводная азотная кислота подвергается автопротолизу по реакции:

Вода сдвигает равновесие влево, поэтому в 93-95 % азотной кислоте катион нитрония уже не обнаруживается. В связи с этим азотная кислота используется в смеси со связывающей воду концентрированной серной кислотой илиолеумом: в 10%-ном растворе азотной кислоты в безводной серной кислоте равновесие практически полностью сдвинуто вправо.
Кроме смеси серной и азотной кислот используются различные комбинации оксидов азота и органических нитратов с кислотами Льюиса (AlCl3, ZnCl2, BF3). Сильными нитрующими свойствами обладает смесь азотной кислоты с уксусным ангидридом, в которой образуется смесь ацетилнитрата и оксида азота(V), а также смесь азотной кислоты с оксидом серы(VI) или оксидом азота(V).
Процесс проводят либо при непосредственном взаимодействии нитрующей смеси с чистым веществом, либо в растворе последнего в полярном растворителе (нитрометан, сульфолан, уксусная кислота). Полярный растворитель кроме того, что растворяет реагирующие вещества, сольватирует ион [H2NO3]+ и способствует его диссоциации.
В лабораторных условиях чаще всего используются нитраты и соли нитрония, нитрующая активность которых возрастает в следующем ряду:

Механизм нитрования бензола:

Кроме замещения атома водорода нитрогруппой применяется также заместительное нитрование, когда нитрогруппа вводится вместо сульфо-, диазо- и других групп.
Нитрование алкенов при действии апротонных нитрующих агентов идёт по нескольким направлениям, которое зависит от условий реакции и строения исходных реагентов. В частности, могут протекать реакции отщепления протона и присоединения функциональных групп молекул растворителя и противоионов:
Нитрование аминов приводит к N-нитроаминам. Этот процесс является обратимым:

Нитрование аминов проводят концентрированной азотной кислотой, а также её смесями с серной кислотой, уксусной кислотой или уксусным ангидридом. Выход продукта увеличивается при переходе от сильноосновных аминов к слабоосновным. Нитрование третичных аминов идёт с разрывом связи C-N (реакция нитролиза); эта реакция используется для получения взрывчатых веществ - гексогена и октогена - из уротропина.
Заместительное нитрование ацетамидов, сульфамидов, уретанов, имидов и их солей протекает по схеме

Реакцию ведут в апротонных растворителях с использованием апротонных нитрующих агентов.
Спирты нитруются любыми нитрующими агентами; реакция является обратимой:

Нуклеофильное нитрование[править | править исходный текст]
Эта реакция используется для синтеза алкилнитритов. Нитрующими агентами в этом типе реакций являются соли нитриты щелочных металлов в апротонных диполярных растворителях (иногда - в присутствии краун-эфиров). Субстратами являются алкилхлориды и алкилиодиды, α-галогенкарбоновые кислоты и их соли, алкилсульфаты. Побочными продуктами реакции являются органические нитриты.
Радикальное нитрование[править | править исходный текст]
Радикальное нитрование применяется для получения нитроалканов и нитроалкенов. Нитрующими агентами являются азотная кислота или оксиды азота:



Параллельно протекает реакция окисления алканов ввиду взаимодействия радикала NO2• с алкильным радикалом по атому не азота, а кислорода. Реакционноспособность алканов возрастает при переходе от первичных к третичным. Реакцию проводят как в жидкой фазе (азотной кислотой при нормальном давлении или оксидами азота, при 2-4,5 МПа и 150-220°C), так и в газовой (пары азотной кислоты, 0,7-1,0 МПа, 400-500°C)
Нитрование алкенов по радикальному механизму проводят 70-80%-ной азотной кислотой, иногда - разбавленной азотной кислотой в присутствии оксидов азота. Циклоалкены, диалкил- и диарилацетилены нитруют оксидом N2O4, при этом образуются цис- и транс-нитросоединения, побочные продукты образуются ввиду окисления и деструкции исходных субстратов.
Анион-радикальный механизм нитрования наблюдается при взаимодействии тетранитрометана солей моно-нитросоединений.
Реакция Коновалова(для алифатических углеводородов)
Реакция Коновалова — нитрование алифатических, алициклических и жирноароматических соединений разбавленной НNО3 при повышенном или нормальном давлении (свободнорадикальный механизм). Реакция с алканамивпервые осуществлена М. И. Коноваловым в 1888 году (по другим данным, в 1899 году) с 10—25%-ной кислотой в запаянных ампулах при температуре 140—150°C.
Обычно образуется смесь первичных, вторичных и третичных нитросоединений. Жирноароматические соединения легко нитруются в α-положение боковой цепи. Побочными реакциями являются образование нитратов, нитритов, нитрозо- и полинитросоединений.
В промышленности реакцию проводят в паровой фазе. Этот процесс разработан Х. Гессом (1930). Пары алкана и азотной кислоты на 0,2—2 секунды нагревают до 420—480°C, затем следует быстрое охлаждение. Метан даёт нитрометан, а его гомологи претерпевают также разрыв связей C——C, так что получается смесь нитроалканов. Её разделяют перегонкой.

Активный радикал в этой реакции — O2NO·, продукт термического расщепления азотной кислоты. Механизм реакции дан ниже.
2HNO3 —t°→ O2NO· + ·NO2 + H2O
R—H + ·ONO2 → R· + HONO2
R· + ·NO2 → R—NO2
Нитрование ароматических углеводородов.
Химические свойства[править | править исходный текст]
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
Восстановление нитросоединений (Реакция Зинина):

Реакции конденсации
Таутомерия нитросоединений.
Таутомери́я (от греч. ταύτίς — тот же самый и μέρος — мера) — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга.[1] При этом устанавливается таутомерное равновесие, и вещество одновременно содержитмолекулы всех изомеров (таутомеров) в определённом соотношении.
Чаще всего при таутомеризации происходит перемещение атомовводорода от одного атома в молекуле к другому и обратно в одном и том же соединении. Классическим примером является ацетоуксусный эфир, представлющий собой равновесную смесь этилового эфира ацетоуксусной (I) и оксикротоновой кислот (II).
Таутомерия сильно проявляется для целого круга веществ, производных циановодорода. Так уже сама синильная кислота существует в двух таутомерных формах:
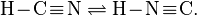
При комнатной температуре равновесие превращения циановодорода в изоциановодород смещено влево. Показано, что менее стабильный изоциановодород более токсичен.


Таутомерные формы фосфористой кислоты
Аналогичное превращение известно для циановой кислоты, которая известна в трёх изомерных формах, однако таутомерное равновесие связывает только две из них: циановую и изоциановуюкислоты:
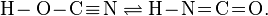
Для обеих таутомерных форм известны сложные эфиры, то есть продукты замещения в циановой кислоте водорода на углеводородные радикалы. В отличие от указанных таутомеров третий изомер — гремучая (фульминовая) кислотане способна к самопроизвольному превращению в другие формы.
С явлением таутомерии связаны многие химико-технологические процессы, особенно в области синтезалекарственных веществ и красителей (производство витамина С — аскорбиновой кислоты в др.). Очень важна роль таутомерии в процессах, протекающих в живых организмах.
Амид-иминольную таутомерию лактамов называют лактам-лактимной таутомерией. Она играет большую роль в химии гетероциклических соединений. Равновесие в большинстве случаев смещено в сторону лактамной формы.
Особенно велик перечень органических загрязняющих веществ. Их разнообразие и большая численность делают практически невозможным контроль за содержанием каждого из них. Поэтому выделяют приоритетные загрязнители (около 180 соединений, объединенные в 13 групп): ароматические углеводороды, полиядерные ароматические углеводороды (ПАУ), пестициды (4 группы), летучие и малолетучие хлорорганические соединения, хлорфенолы, хлоранилины и хлорнитроароматические соединения, полихлорированные и полибромированные бифенилы, металлорганические соединения и другие. Источниками этих веществ являются атмосферные осадки, поверхностные стоки и производственные и коммунально-бытовые СВ.






