ПРОСТЫЕ ЭФИРЫ – класс органических соединений содержащих фрагмент R–O–R', в котором две органические группы соединены атомом кислорода. Прилагательное «простые» в названии эфиров помогает отличить их от другого класса соединений, именуемого сложными эфирами.
Номенклатура простых эфиров. Если группы R и R' в простом эфире одинаковы, то его называют симметричным, если разные – несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C2H5OC3H7 – пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C2H5OC2H5 – диэтиловый эфир. Для многих эфиров часто используют тривиальные (упрощенные) названия, сложившиеся исторически. К простым эфирам иногда относят соединения, которые содержат эфирный фрагмент С–О–С в составе циклической молекулы (рис. 1), одновременно их причисляют к другому классу соединений – гетероциклическим соединениям. Есть также соединения (см. АЛЬДЕГИДЫ И КЕТОНЫ), в состав которых входит фрагмент С–О–С, но к классу эфиров их не относят, это полуацетали – соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR, а также ацетали – соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2 (рис. 1). Наличие у одного атома углерода сразу двух химически связанных атомов О делает эти соединения непохожими по химическим свойствам на простые эфиры.
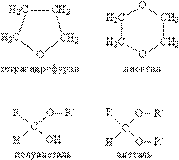
Рис. 1. ПРОСТЫЕ ЭФИРЫ, содержащие эфирный фрагмент в составе циклической молекулы (чаще такие соединения относят к гетероциклическим), а также полуацетали и ацетали, содержащие эфирный фрагмент, но не относящиеся к классу простых эфиров.
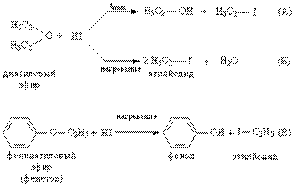
Химические свойства простых эфиров. Простые эфиры представляют собой бесцветные жидкости с характерным (так называемым эфирным) запахом, практически не смешиваются с водой и неограниченно смешиваются с большинством органических растворителей. В сравнении со спиртами и альдегидами простые эфиры химически менее активны, например, они устойчивы к действию щелочей и щелочных металлов (металлический Na применяют даже для удаления следов воды из эфиров). В отличие от щелочей, кислоты расщепляют эфирный фрагмент, для этого чаще применяют галоидоводороды, особенно эффективен HI. При комнатной температуре образуется и спирт, и йодистый алкил (рис. 2А), а при нагревании – йодистый алкил и вода (рис.2А), т.е. реакция протекает более глубоко. Простые эфиры, содержащие ароматические циклы, более устойчивы к расщеплению, для них возможна только стадия, аналогичная А, образуется фенол, а йод к ароматическому ядру не присоединяется (рис. 2В).
Изомерия простых эфиров:
Изомерия углеродного скелета: изменения в структуре радикалов дают разные изомеры
Межклассовая изомерия — простые эфиры изомерны одноатомным спиртам
Способы получения
По Вильямсону
В лабораторных условиях эфиры получают по Вильямсону взаимодействием галогенопроизводных, способных вступать в реакцию Sn2 и алкоксид- и феноксид-ионами. Реакция протекает гладко с галогенметаном и первичными галогеналканами. В случае вторичных галогеналканов реакция может быть осложнена побочной реакцией элиминирования.
Тиоспирты, тиофенолы и тиоэфиры: строение, номенклатура, изомерия, методы получения и химические свойства. Источники их поступления в атмосферу и участие в фотолитических окислительных процессах.


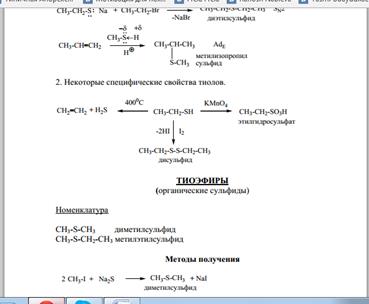


Соединения серы - Тиоспирты (меккаптаны), и тиоэфиры (сульфиды). Сера стоит в таблице Менделеева в той же группе, что и кислород, и является его аналогом. Соединение серы с водородом H2S является аналогом воды.
Тиоспирты и тиоэфиры можно рассматривать как производные H2S, в молекулах которого один или два атома H замещены на углеводородные радикалы:
Метилмеркаптин - газ, все аналоги и тиоэфиры - жидкие или твердые вещества. Тиолы и тиоэфиры плохо растворяются в воде, хорошо - в органических растворителях. Все меркаптаны имеют неприятный запах (тухлой капусты), что ощущается при очень малых концентрациях
Тиоэфиры - нейтральные вещества. При воздействии на них окислителей образуются сульфоксиды или сульфоны
C2H5-S-C2H5 + [O] -> CjH5-SO-C2H5 + [O] -> C2H5-SO2-C2H5 альбендазола сульфон
С тиоэфиров широко известный иприт (горчичный газ). Его добывают действием этилена на пивхлористу серу
Физические и химические свойства.
фосфин - газообразные или жидкие вещества с неприятным запахом, очень токсичны. В воде не растворяются, на воздухе окисляются с самовоспламенением, образуя окислы фосфинов:
P (CH3J3 + O -> (CHa) 3P = O - триметилфосфиноксид
PH2CH3 + HCI -»[PH3CH3] CI - соль хлоридмонометилфосфинию.
Третичные фосфины с сероуглеродом образуют продукт ярко-красного цвета: (C2H5J3P + CS2 -> (C2Hg) 3P-CS2
Эта реакция применяется для обнаружения и идентификации сероуглерода.
ФоссЬинови кислоты.
фосфина кислоты можно рассматривать как производные ортофосфорной кислоты H3PO4, в молекуле которого один или два гидроксилы замещены на радикалы.
фосфина кислоты - бесцветные кристаллические вещества, которые легко растворяются в воде, их доюувають окислением первичных и вторичных фосфинов азотной кислотой:
CH3-PH2 + ЗО -> CH3-PO (OH) 2 - метилфосфинова кислота Первиннний фосфин
CH3-PH-CH3 + 2О -> (СН3) 2-Роон - диметилфосфинова кислота Вторичный фосфин С производных фосфиновых кислот важное значение имеют инсектициды.
Отдельные представители.
Хлорофос - препарат для борьбы с оводом, мухами, вредителями растений (малотоксичен для млекопитающих):
OH
снзо
снзо
CH-cci.
CH.
-CH
23 OH етилфосфинова кислота хлорофос
тиофос - густая маслянистая жидкость темно-красного цвета. Имеет запах чеснока, токсичен. В воде растворяется плохо, хорошо - в органических растворителях. Применяют для борьбы с вредными насекомыми:
- °
0 -. - N +
Очень ядовитым является табун (этиловый эфир N-диметиламідоціанофосфінової кислоты):
CN
СНз ^ N-
CH
P - OC2H5
Это ядовитое вещество нервно-паралитического действия. Табун - малорастворимая в воде вещество со слабым фруктовым запахом. Пары табуну токсическое воздействие на дыхательные пути и слизистые оболочки, проникают через кожу, вызывают головную боль.
Заголовок 42. Физиологически активных веществ.
Это вещества, которые активно влияют на различные процессы жизнедеятельности организмов.
Алкалоиды.
Название происходит от арабского «аль кале" - луг.
Это группа природных азотсодержащих соединений, проявляющих основные свойства. Воны гетероциклического строения, которые прявляють ярко выраженную физиологическое действие на живой организм.
Это продукты життюдияльности преимущественно растений. Большинство из них ядовиты, но в малых дозах много алкалоидов является ценным лекарством. Алкалоиды содержатся в различных органах растений. Так, никотин содержится в листьях табака, хинин - в коре хинного дерева, алкалоиды опия (морфин, кодеин) - в семенах мака. Если в сырье 1-2% алкалоидов, то ТЕ 'считают богатой алкалоиды.
Алкалоиды содержатся в виде солей органических кислот (щавелевой, яблочной, лимонной). Для выделения из растений их измельчают и обрабатывают разбавленными кислотами. Алкалоиды при этом переходят в раствор в виде солянокислых или сернокислых солей. При обработке раствора щелочью алкалоиды выпадают в осадок в виде свободных оснований, из которых их можно выделить экстракцией (эфиром, хлороформом) или перегонки с водяным паром.
Имеют сложное строение. Алкалоиды делят на кислородные и бескислородные.






