1. Метод ,
(Для барбитуратов-кислот)
Метод основан на
Методика:
 | |||
 | |||
R R ДМФА
O = ↔ + NaOH →
 |
моль экв.
→ + H 2 O
fэкв. = M1/z =
2. Метод , вариант
способ
(Для барбитуратов-кислот)
Метод основан на
Методика:
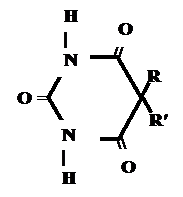 |  | ||
↔ + NaOH →

моль экв.
→ + H 2 O
fэкв. = 1 M1/z = Mm
3. Метод , способ
(Для барбитуратов-солей)
Метод основан на

 Методика:
Методика:
+ HOH → ↓ + NaOH
моль моль
NaOH + HCl → NaCl + H 2 O
моль экв.
fэкв. = M1/z =
4. Метод
Метод основан на
А) без индикатора –
 | |||
 | |||
+ Na2CO3
+ А gNO3 ®
- 2 NaNO3
- CO2
- H2O
моль экв.

|
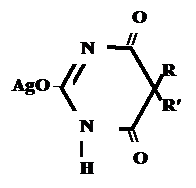 + Na2CO3
+ Na2CO3
+ AgNO3 → ↓
- 2 NaNO3
- CO2
- H2O
fэкв. = M1/z =
 Б) с индикатором –хроматом калия –
Б) с индикатором –хроматом калия –
 |
+ 2 А gNO 3 ® ↓
моль экв.
2 AgNO 3 + K 2 CrO 4 → Ag 2 CrO 4 ↓ + 2 KNO 3
fэкв. = M1/z =
4.
5.
6.
БАРБИТУРАТЫ – КИСЛОТЫ
Свойства
| Барбитал Веронал | Фенобарбитал Люминал |
| Barbitalum Veronalum Barbital* | Phenobarbitalum Luminalum Phenobarbital* |

| 
|
| 5,5- диэтил-барбитуровая кислота | 5-этил-5-фенил-барбитуровая кислота |
|
| |
|
| |
|
Подлинность | |
| 1.
| |
| 2.
| |
| 3.
| |
| 4. | |
| 5. | |
| 6. | |
| 7. | |
|
Количественное епределение | |
| 1. Метод , (ГФ) | |
| 2. Метод , вариант (экспресс) | |
| 3. Метод | |
| 4. Метод | |
| 5. Метод | |
| 6. Метод | |
|
Применение | |
|
Форма выпуска:
| |
|
Хранение | |
|
| |
БАРБИТУРАТЫ – СОЛИ
| Барбитал-натрий Мединал | Этаминал-антрий Нембутал |
| Barbitalum-natrium Medinalum Barbital Sodium* | Aethaminalum-natrium Nembutalum |

| 
|
| 5,5-диэтилбарбитурат натрия | 5-этил-5-(2-амил)-барбитурат натрия |
|
Свойства | |
|
| |
|
Подлинность | |
|
1.
| |
|
2.
| |
|
3.
| |
|
4.
| |
|
5. | |
|
Количественное определение | |
| 1. Метод , способ (ГФ и экспресс) | |
| 2. Метод | |
| 3. Метод | |
| 4. Метод | |
| 5. Метод | |
|
Применение | |
| Форма выпуска:
| |
|
| |
|
Хранение | |
|
| |
ВИТАМИНЫ ПИРИМИДИНТИАЗОЛОВОГО РЯДА И ИХ ПРОИЗВОДНЫЕ
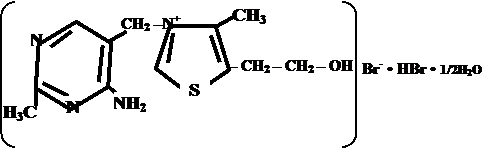
| Тиамина хлорид | Тиамина бромид | ||||||||||
| Thiamini chloridum Thiamine Chloride* | Thiamini bromidum Thiamine Bromide* | ||||||||||
| Vitaminum B1 | |||||||||||
|
| ||||||||||
4-метил-5 β -оксиэтил- N -(2 ′ -метил- 4 ′ - амино-5 ′ -метилпиримидил)-тиазолий | |||||||||||
| хлорида гидрохлорид | бромида гидробромид | ||||||||||
|
Свойства | |||||||||||
|
| |||||||||||
|
| |||||||||||
|
Подлинность | |||||||||||
|
1. | |||||||||||
|
2.
| |||||||||||
|
3. | |||||||||||
|
4. | |||||||||||
|
5. | |||||||||||
|
6. | |||||||||||
|
8. | |||||||||||
| (на хлорид-ион)— | (на бромид-ион) — | ||||||||||
| 8. (на бромид-ион – отличие) — | |||||||||||
|
Количественное определение | |||||||||||
| 1. Метод | |||||||||||
| 2. Метод , (ГФ) [Thiam]•Cl•HCl + 2 HClO4 + Hg(CH3COO)2 → [Thiam]•2HClO4 + HgCl2 + 2 CH3COOH fэкв. = M1/z = | |||||||||||
| 3. Метод Проводят нейтрализацию щелочью. Сумму бромид-ионов оттитровывают нитратом серебра. Расчеты ведут по разнице объемов (VAgNO3 – VNaOH) 2 AgNO3 [R3N]•Br•HBr + NaOH → [R3N]•Br + NaBr → [R3N]•NO3 + 2 AgBr↓ + NaNO3 fэкв. = 1/2 M1/z = Mm/2 | |||||||||||
| 4. Метод Методика:
| |||||||||||
| [R3N]•Cl•HCl + NaOH → [R3N]•Cl + NaCl + Н2О | [R3N]•Br•HBr + NaOH → [R3N]•Br + NaBr + Н2О | ||||||||||
| fэкв. = M1/z = | |||||||||||
| 5. Метод | |||||||||||
|
Применение | |||||||||||
| - - - - - Форма выпуска: | |||||||||||
|
Хранение | |||||||||||
|
| |||||||||||
АЛКАЛОИДЫ
Физические свойства
Алкалоиды-основания
Алкалоиды-соли -
Химические свойства
∙∙
R3N + H+X- → [R3N+]X-
|
H
R3N • HCl + NaOH → NaCl + R3N↓ + H2O
Общеалкалоидные реакции
1. Реактив Бушарда, Вагнера или Люголя (: KI + I2= KI3
) –
2. Реактив Майера (HgI2 + КI = K2[HgI4] -
) –
(исключение: кофеин и колхицин)
3. Реактив Драгендорфа (BiI3 + KI = K[BiI4] –
) –
4. Реактив Зонненштейна (H3PO4•12MoO3•2H2O -
) –
Это наиболее чувствительный реактив на алкалоиды.
5. Реактив Шейблера (H3PO4•12WO3•2H2O –
) –.
6. Раствор танина (свежеприготовленный 10%-ый водный раствор) –
7. Пикриновая кислота (1%-ый раствор) –
(исключение: кофеин, теобромин, морфин).
8. Реактив Марки (раствор формалина в концентрированной серной кислоте) –
9. Реактив Фреде (раствор молибдата аммония (NH4)2MoO4 в концентрированной серной кислоте) –
10. Реактив Марме (CdI2 + KI ) -






