Принцип метода состоит в сопоставлении графиков зависимости накопления биомассы от времени культивирования (см. рис. 21) с кривой продуктивности по выходу биомассы dx/ dt. Для этого в правой половине графика зависимости образования биомассы от времени культивирования (кривая X) наносят кривую зависимости продуктивности культуры по выходу биомассы от ее концентрации, т. е. dX/dt от X в тех же единицах оптической плотности (ед. ОП) (кривая  ) (рис. 25).
) (рис. 25).
Величина dX/dt рассчитывается по данным кривой роста.
Пример: Х2 = 3 ед. ОП; Х1= 1,5 ед. ОП, t2 = 4,5 ч t1 = 3,5 ч тогда dX/dt = 1,5 ед. ОП/ч.

Рисунок 25. Кривая роста культуры (Х) и кривая продуктивности по выходу биомассы  .
.
На кривой зависимости продуктивности культуры находим точку, соответствующую максимальному значению dX/dt. При пересечении перпендикуляра с осью абсцисс находим точку, которая соответствует состоянию динамического равновесия при непрерывном культивировании dX/dt (например, 1,5 ед. ОП/ч). Проведя параллель по найденной точке до пересечения с осью ординат, находим показатель оптической плотности, соответствующий определенной концентрации биомассы X (например, 3 ед. ОП). Продлив эту прямую до пересечения с кривой роста, находим фазу роста, в которой будет поддерживаться культура. Опустив перпендикуляр на ось абсцисс со шкалой времени культивирования, находим время, необходимое для выхода культуры в нужную фазу роста и начала проточного культивирования. В стационарных условиях скорость протока (D) равна удельной скорости роста (μ). Их рассчитываем по формуле:

Таким образом, находим, что если при оптической плотности культуры, равной 3 в ферментере включить проток со скоростью 0,5 ч-1, то производительность процесса получения биомассы будет максимальна. Культивирование будет осуществляться в режиме турбидостата.
Задания
Задание 1. Получение кривой роста культуры микроорганизмов
1. Выбрать вариант культивирования
Примерные варианты культивирования микроорганизмов представлены в таблице 4.
Таблица 4. Варианты культивирования микроорганизмов
| № | Микроорганизм | Среда | Субстрат | Температура, °С | Режим аэрации, об/мин |
| 1 | E.coli K12 | LB | - | 28 | 180 |
| 2 | E.coli K12 | LB | - | 37 | 180 |
| 3 | Pseudomonas putida NF142 | LB | - | 28 | 180 |
| 4 | Arthrobacter sp.BS2 | LB | - | 28 | 180 |
| 5 | Gluconobacter oxidans | Среда G | сорбит | 28 | 180 |
| 6 | Pichia sp. 2518 | Cреда Y | Глюкоза (10 г/л) | 28 | 180 |
| 7 | Pichia sp. 2518 | Cреда Y | Глицерин (10 г/л) | 28 | 180 |
Среды для культивирования
LB (Лурия – Бертрани): триптон - 10г/л, дрожжевой экстракт - 5 г/л, NaCl - 10 г/л. Довести рН до 7,5.
Среда Y: (NH4)2SO4 - 2,5 г/л, MgSO4 - 0,2 г/л, K2HPO4x 3 H2O - 0,7 г/л, NaH2PO4x 3 H2O - 3 г/л, дрожжевой экстракт - 0,5 г/л, DL-лейцин - 0,17 г/л, глицерин – 8,3 мл/л (или глюкоза 10 гл), микроэлементы (ЭДТА-10г/л, ZnSO4x 7H2O - 4.4 г/л, MnCl2 х 4H2O - 1,01 г/л, CoCl2 х 6H2O - 0,32 г/л, CuSO4 х 5H2O - 0,315г/л, (NH4)6Mo7O24 х 4H2O - 0,22г, CaCl2 х 2H2O - 1,47 г/л, FeSO4 х 7H2O - 1 г/л) - 1 мл.
Среда G: D-сорбит - 200 г/л; Дрожжевой экстракт - 20 г/л; Дистиллированная вода - 100 мл; pH среды - 5,2-5,5
Для приготовления агаризованных сред к жидким средам добавить агара из расчета 16-20 г/л
2. Приготовить питательную среду для выращивания бактерий:
‑ приготовить среды согласно прописи;
– среду разлить в 3 ферментационные колбы по 100 мл;
– колбы плотно закрыть ватно-марлевыми пробками и стерилизовать автоклавированием 30 мин при 121°С;
– после автоклавирования колбы подписать (отметить микроорганизм, который будете засевать, дату, фамилию и номер колбы);
3. Засев инокулята:
‑ Засеять одну колбу для инокулята культурой и инкубировать (культивировать) в течение суток при заданных условиях;
‑ На следующий день засеять одну из колб, добавив 5-10 мл инокулята (инокулят хранить в холодильнике до засева второй колбы);
– Измерить исходную оптическую плотность культуры, для чего отобрать 2,5 мл культуры в отдельную пробирку и измерить оптическую плотность на спектрофотометре относительно воды при длине волны 590 нм;
‑ Вторую колбу засеять через 8 часов, добавив 5-10 мл того же инокулята, который добавляли в первую колбу;
4. Колбы установить на качалку с заданными параметрами температуры и аэрации.
5. Периодически (через 1-2 часа) производить отбор проб для измерения оптической плотности культуры.
6. Данные занести в табл. 5.
Таблица 5. Показатели роста культуры в ходе периодического культивирования
| Дата | Время | Время от начала засева (колба 1), ч | Оптическая плотность А1, ед. (колба1) | Время от начала засева (колба 2), ч | Оптическая плотность А2, ед (колба2) |
7. По результатам эксперимента построить кривые роста культур бактерий (оптическая плотность от времени культивирования и ln оптической плотности от времени), объединив значение полученные для первой и для второй колбы (время берут из таблицы 1 - время от начала засева по колбе 1 и 2).
8. Рассчитать параметры роста данной периодической культуры:
а) длительность фаз (по графику);
б) максимальную удельную скорость роста;
в) время генерации в экспоненциальной фазе роста;
9. Сделать вывод по работе.
Задание 2. Определение КОЕ
- приготовление материала
1. Приготовить 200 мл агаризованной питательной среды для выращивания бактерий.
2. Приготовить физ. раствор и разлить по 14 пробиркам по 4,5 мл.
3. Упаковать 6 чашек Петри.
4. Агаризованную среду, пробирки с физ. раствором и чашки Петри стерилизовать автоклавированием 30 мин при 121°С;
-отбор проб и высев
1. После засева колб отобрать 0,5 мл и добавить в одну из пробирок с 4,5 мл физ. раствора;
2. Приготовить 7 десятикратных разведений культуры;
3. Залить чашки Петри агаризованной средой и подсушить под УФ;
4. Сделать высев по 0,1 мл из соответствующих разведений;
5. Чашки Петри поместить в термостат крышками вниз для инкубации при температуре 28°С на 24 – 48 часов;
6. После завершения снятия кривой роста отобрать 0,5 мл культуральной жидкости, добавить в одну из пробирок с 4,5 мл физ. раствора и повторить п. 2-5.
7. Через 1-2 дня подсчитать число выросших на чашках Петри колоний и рассчитать содержание микроорганизмов (КОЕ/мл) в культуре на момент отбора проб:
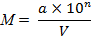
где М – количество клеток в 1 мл;
а – число колоний, выросших после посева из данного разведения;
V – объем суспензии, взятый для посева, мл;
n – коэффициент разведения.
8. Сделать вывод по работе.
Задание 3. Построение кривой роста и расчет параметров роста по известным данным
1. Построить кривую роста культуры по показателям оптической плотности (табл. 5).
2. Рассчитать параметры роста данной периодической культуры:
а) длительность лаг-фазы (по графику);
б) максимальную удельную скорость роста;
в) время генерации в экспоненциальной фазе роста;
3. Используя данные табл. 6, рассчитать экономический коэффициент (выход биомассы от потребленного субстрата) для данной культуры.
Задание 4. Расчет параметров для непрерывного культивирования
1. Построить график зависимости удельной скорости роста от концентрации субстрата для данной культуры на основании данных табл. 7.
2. Рассчитать значение теоретической μmax по формуле (5) при максимальном значении S (табл. 7).
3. По данным графика построенным в обратных координатах(1/μ от 1/S) определить:
а) значение константы Михаэлиса-Ментена (Ks);
в) значение практической максимальной скорости роста (μmax).
4. Графоаналитическим методом рассчитать скорость протока для максимальной продуктивности культуры по выходу биомассы в единицах ОП (в режиме турбидостата), время культивирования в стационарных условиях и подключения подачи питательной среды (по вариантам 1-го этапа).
Контрольные вопросы
1. Какие два основных способа культивирования выделяют в зависимости от способа подачи питательных веществ и отбора получаемых продуктов?
2. Что называют периодическим культивированием? Чем характеризуется данный способ культивирования?
3. Что называют инокулятом?
4. Чем описывается рост микроорганизмов в периодическом режиме культивирования?
5. Какие фазы роста выделяют при периодическом культивировании микроорганизмов? Дайте характеристику каждой фазе роста.
6. Что называют непрерывным культивированием?
7. Как называют аппарат для непрерывного культивирования микроорганизмов?
8. Что характеризует скорость разбавления? Как рассчитать скорость разбавления?
9. Какие способы непрерывного культивирования выделяют в зависимости от контроля и управления процессами? Дайте характеристику этим способам?
10. Какие основные параметры роста периодической культуры анализируют? Как рассчитать эти параметры?
11. Какие параметры роста являются важными при непрерывном культивировании микроорганизмов?
12. Что характеризует величина Ks? Как ее определяют?
13. В чем заключается графоаналитический метод расчета условий непрерывного культивирования?
Таблица 5. Зависимость биомассы (Х), единицы оптической плотности (ОП) от времени культивирования (Т) на углеродном субстрате
| № | Культура | Субстрат | Время культивирования, ч | |||||||||||
| 0 | 2 | 4 | 6 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |||
| Показания оптической плотности | ||||||||||||||
| 1 | Candida utilis | глюкоза | 0,1 | 0,105 | 0,11 | 0,12 | 0,15 | 0,33 | 0,5 | 0,6 | 0,62 | 0,63 | 0,64 | 0,64 |
| 2 | Rhococcus sp. | фенол | 0,07 | 0,072 | 0,075 | 0,079 | 0,09 | 0,13 | 0,18 | 0,25 | 0,3 | 0,33 | 0,34 | 0,35 |
| 3 | Pseudomonas sp. | метанол | 0,085 | 0,087 | 0,09 | 0,096 | 0,12 | 0,19 | 0,27 | 0,34 | 0,39 | 0,42 | 0,43 | 0,44 |
| 4 | Saccharomyces sp. | сахароза | 0,1 | 0,102 | 0,105 | 0,109 | 0,12 | 0,17 | 0,23 | 0,31 | 0,38 | 0,44 | 0,47 | 0,48 |
| 5 | Methylococcus sp. | пропионат | 0,051 | 0,052 | 0,053 | 0,055 | 0,06 | 0,08 | 0,12 | 0,2 | 0,3 | 0,38 | 0,44 | 0,44 |
| 6 | Cryptococcus sp. | маннит | 0,05 | 0,053 | 0,058 | 0,066 | 0,087 | 0,15 | 0,22 | 0,285 | 0,34 | 0,36 | 0,36 | 0,36 |
| 7 | Rhodopseudomonas capsulata | ацетат | 0,05 | 0,053 | 0,064 | 0,078 | 0,112 | 0,2 | 0,31 | 0,43 | 0,49 | 0,5 | 0,5 | 0,5 |
| 8 | Bacillus turing | глюкоза | 0,05 | 0,05 | 0,06 | 0,1 | 0,2 | 0,5 | 0,73 | 0,81 | 0,86 | 0,88 | 0,88 | 0,88 |
| 9 | Candida scotti | мальтоза | 0,07 | 0,07 | 0,08 | 0,1 | 0,15 | 0,29 | 0,5 | 0,75 | 0,88 | 0,9 | 0,9 | 0,9 |
| 10 | Mycobacterium sp. | каприловая кислота | 0,06 | 0,061 | 0,065 | 0,072 | 0,095 | 0,16 | 0,24 | 0,28 | 0,31 | 0,33 | 0,33 | 0,33 |
| 11 | Brevibacterium sp. | нафталин | 0,03 | 0,032 | 0,035 | 0,039 | 0,048 | 0,1 | 0,17 | 0,3 | 0,45 | 0,5 | 0,53 | 0,55 |
| 12 | Arthrobacter sp. | нафталин | 0,06 | 0,06 | 0,062 | 0,064 | 0,069 | 0,083 | 0,098 | 0,15 | 0,34 | 0,52 | 0,57 | 0,57 |
| 13 | Metilobacter sp. | метанол | 0,02 | 0,02 | 0,023 | 0,031 | 0,05 | 0,16 | 0,3 | 0,46 | 0,58 | 0,65 | 0,68 | 0,7 |
| 14 | Pseudomonas putida | капролактам | 0,05 | 0,06 | 0,073 | 0,095 | 0,15 | 0,33 | 0,52 | 0,65 | 0,7 | 0,73 | 0,74 | 0,75 |
| 15 | Pseudomonas putida | нафталин | 0,103 | 0,104 | 0,106 | 0,11 | 0,13 | 0,21 | 0,35 | 0,52 | 0,62 | 0,68 | 0,7 | 0,7 |
| 16 | Pichia angusta | глицерин | 0,115 | 0,117 | 0,119 | 0,12 | 0,123 | 0,135 | 0,15 | 0,19 | 0,36 | 0,55 | 0,57 | 0,58 |
| 17 | Pichia angusta | этанол | 0,06 | 0,06 | 0,07 | 0,082 | 0,13 | 0,3 | 0,51 | 0,63 | 0,73 | 0,76 | 0,79 | 0,8 |
| 18 | Gluconobacter oxidans | сорбит | 0,017 | 0,019 | 0,025 | 0,029 | 0,04 | 0,08 | 0,15 | 0,28 | 0,5 | 0,8 | 0,88 | 0,9 |
| 19 | Azotobacter sp. | Глюкоза + кадмий | 0,018 | 0,018 | 0,018 | 0,019 | 0,025 | 0,04 | 0,06 | 0,13 | 0,27 | 0,4 | 0,42 | 0,42 |
| 20 | Arthrobacter sp. | глюкоза + кадмий | 0,02 | 0,02 | 0,02 | 0,023 | 0,06 | 0,19 | 0,31 | 0,4 | 0,42 | 0,44 | 0,45 | 0,45 |
| 21 | Eschericia coli | глюкоза | 0,03 | 0,03 | 0,03 | 0,033 | 0,05 | 0,1 | 0,18 | 0,33 | 0,45 | 0,5 | 0,5 | 0,5 |
| 22 | Pseudomonas sp. | капролактам | 0,05 | 0,05 | 0,05 | 0,052 | 0,055 | 0,068 | 0,095 | 0,18 | 0,35 | 0,45 | 0,48 | 0,48 |
| 23 | Brevibacterium sp. | нафталин | 0,11 | 0,11 | 0,114 | 0,12 | 0,135 | 0,2 | 0,3 | 0,45 | 0,7 | 0,9 | 0,95 | 0,95 |
| 24 | Arthrobacter sp. | нафталин | 0,08 | 0,082 | 0,084 | 0,087 | 0,096 | 0,124 | 0,25 | 0,65 | 0,87 | 0,9 | 0,92 | 0,94 |
| 25 | Arthrobacter sp. | Нафталин + 5%NaCl | 0,014 | 0,015 | 0,018 | 0,026 | 0,045 | 0,13 | 0,24 | 0,41 | 0,57 | 0,7 | 0,75 | 0,77 |
| 26 | Eschericia coli | маннит | 0,008 | 0,01 | 0,01 | 0,012 | 0,02 | 0,06 | 0,21 | 0,52 | 0,7 | 0,84 | 0,85 | 0,85 |
| 27 | Candida sp. | глицерин | 0,108 | 0,11 | 0,112 | 0,12 | 0,15 | 0,25 | 0,4 | 0,7 | 0,95 | 1,18 | 1,2 | 1,2 |
Таблица 6. Выход биомассы, начальная концентрация субстрата в среде и остаточные концентрации в культуральной жидкости
| № | Культура | Субстрат | Биомасса, ед. ОП (Х) | Начальная концентрация субстрата в среде, мг/л (S) | Остаточная концентрация субстрата в культуральной жидкости, мг/л (S0) |
| 1 | Candida utilis | Глюкоза | 500 | 1000 | 100 |
| 2 | Rhococcus sp. | Фенол | 200 | 500 | 50 |
| 3 | Pseudomonas sp. | Метанол | 100 | 250 | 20 |
| 4 | Saccharomyces sp. | Сахароза | 500 | 2000 | 1000 |
| 5 | Methylococcu ssp. | Пропионат | 300 | 2000 | 900 |
| 6 | Cryptococcus sp. | Маннит | 550 | 1000 | 150 |
| 7 | Rhodopseudomonas capsulata | Ацетат | 480 | 2000 | 800 |
| 8 | Bacillus turing | Глюкоза | 540 | 1000 | 80 |
| 9 | Candida scotti | Мальтоза | 400 | 1000 | 100 |
| 10 | Mycobacterium sp. | Каприловая кислота | 200 | 1000 | 500 |
| 11 | Brevibacterium sp. | Нафталин | 500 | 1000 | 100 |
| 12 | Arthrobacter sp. | Нафталин | 450 | 1000 | 100 |
| 13 | Metilobacte rsp. | Метанол | 200 | 500 | 30 |
| 14 | Pseudomonas putida | Капролактам | 500 | 2000 | 20 |
| 15 | Pseudomonas putida | Нафталин | 350 | 1000 | 100 |
| 16 | Pichia angusta | Глицерин | 500 | 1500 | 50 |
| 17 | Pichia angusta | Этанол | 450 | 1000 | 80 |
| 18 | Gluconobacter oxidans | Сорбит | 350 | 1000 | 120 |
| 19 | Azotobacter sp. | Глюкоза+кадмий | 200 | 1000 | 200 |
| 20 | Arthrobacter sp. | Глюкоза + кадмий | 100 | 1000 | 250 |
| 21 | Eschericia coli | Глюкоза | 300 | 1000 | 20 |
| 22 | Pseudomonas sp. | Капролактам | 300 | 1000 | 50 |
| 23 | Brevibacterium sp. | Нафталин | 540 | 1000 | 100 |
| 24 | Arthrobacter sp. | Нафталин | 400 | 1000 | 120 |
| 25 | Arthrobacter sp. | Нафталин+5%NaCl | 200 | 1000 | 200 |
| 26 | Eschericia coli | Маннит | 500 | 2000 | 300 |
| 27 | Candida sp. | Глицерин | 450 | 1500 | 100 |
Таблица 7. Зависимость удельной скорости роста культур (µ) от концентрации субстрата (S)
| № | Культура | Субстрат | параметры | ||||||||
| 1
| Candida utilis | глюкоза
| S мг/л | 20 | 40 | 80 | 120 | 160 | 200 | 300 | |
| μ ч-1 | 0,2 | 0,3 | 0,4 | 0,43 | 0,46 | 0,47 | 0,47 | ||||
| 2
| Rhococcus sp. | фенол
| S мг/л | 100 | 140 | 160 | 240 | 600 | 800 | 1000 | |
| μ ч-1 | 0,07 | 0,09 | 0,1 | 0,13 | 0,19 | 0,2 | 0,2 | ||||
| 3
| Pseudomonas sp. | метанол
| S мг/л | 10 | 20 | 30 | 40 | 50 | 60 | 80 | |
| μ ч-1 | 0,3 | 0,5 | 0,6 | 0,75 | 0,82 | 0,85 | 0,9 | ||||
| 4
| Saccharomyces sp. | сахароза
| S мг/л | 50 | 100 | 150 | 200 | 300 | 400 | 500 | |
| μ ч-1 | 0,06 | 0,1 | 0,12 | 0,15 | 0,18 | 0,19 | 0,2 | ||||
| 5
| Methylococcus sp. | пропионат
| S мг/л | 50 | 100 | 150 | 200 | 300 | 400 | 500 | |
| μ ч-1 | 0,04 | 0,08 | 0,12 | 0,15 | 0,2 | 0,23 | 0,24 | ||||
| 6
| Cryptococcus sp. | маннит
| S мг/л | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| μ ч-1 | 0,05 | 0,1 | 0,15 | 0,2 | 0,23 | 0,24 | 0,25 | ||||
| 7
| Rhodopseudomonas capsulata | ацетат
| S мг/л | 10 | 20 | 30 | 40 | 50 | 60 | 80 | |
| μ ч-1 | 0,02 | 0,04 | 0,06 | 0,08 | 0,1 | 0,12 | 0,13 | ||||
| 8
| Bacillus turing | глюкоза
| S мг/л | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| μ ч-1 | 0,05 | 0,08 | 0,1 | 0,11 | 0,115 | 0,12 | 0,12 | ||||
| 9
| Candida scotti | мальтоза
| S мг/л | 50 | 100 | 150 | 200 | 300 | 400 | 500 | |
| μ ч-1 | 0,05 | 0,07 | 0,09 | 0,1 | 0,11 | 0,12 | 0,12 | ||||
| 10
| Mycobacterium sp.
| каприловая кислота
| S мг/л | 10 | 20 | 30 | 40 | 50 | 60 | 80 | |
| μ ч-1 | 0,04 | 0,07 | 0,1 | 0,13 | 0,16 | 0,18 | 0,19 | ||||
| 11
| Brevibacterium sp.
| нафталин
| S мг/л | 20 | 35 | 45 | 55 | 70 | 85 | 100 | |
| μ ч-1 | 0,15 | 0,25 | 0,3 | 0,35 | 0,39 | 0,42 | 0,45 | ||||
| 12
| Arthrobacter sp. | нафталин
| S мг/л | 10 | 20 | 35 | 50 | 65 | 75 | 90 | |
| μ ч-1 | 0,04 | 0,07 | 0,1 | 0,12 | 0,13 | 0,13 | 0,13 | ||||
| 13
| Metilobacter sp. | метанол
| S мг/л | 20 | 80 | 150 | 200 | 300 | 400 | 500 | |
| μ ч-1 | 0,02 | 0,08 | 0,14 | 0,18 | 0,21 | 0,24 | 0,25 | ||||
| 14
| Pseudomonas putida
| капролактам
| S мг/л | 5 | 15 | 30 | 40 | 50 | 60 | 80 | |
| μ ч-1 | 0,06 | 0,15 | 0,23 | 0,26 | 0,28 | 0,29 | 0,3 | ||||
| 15
| Pseudomonas putida
| нафталин
| S мг/л | 10 | 25 | 60 | 80 | 100 | 120 | 140 | |
| μ ч-1 | 0,1 | 0,22 | 0,4 | 0,45 | 0,48 | 0,49 | 0,5 | ||||
| 16
| Pichia angusta
| глицерин
| S мг/л | 25 | 50 | 75 | 100 | 125 | 150 | 175 | |
| μ ч-1 | 0,03 | 0,05 | 0,07 | 0,09 | 0,1 | 0,105 | 0,11 | ||||
| 17
| Pichia angusta
| этанол
| S мг/л | 30 | 110 | 190 | 260 | 340 | 420 | 500 | |
| μ ч-1 | 0,03 | 0,11 | 0,17 | 0,21 | 0,23 | 0,24 | 0,25 | ||||
| 18
| Gluconobacter oxidans | сорбит | S мг/л | 20 | 65 | 115 | 160 | 205 | 250 | 300 | |
| μ ч-1 | 0,1 | 0,23 | 0,31 | 0,38 | 0,42 | 0,44 | 0,45 | ||||
| 19
| Azotobacter sp. | глюкоза + кадмий | S мг/л | 20 | 50 | 80 | 110 | 140 | 170 | 200 | |
| μ ч-1 | 0,04 | 0,08 | 0,1 | 0,115 | 0,12 | 0,126 | 0,13 | ||||
| 20
| Arthrobacter sp. | глюкоза + кадмий | S мг/л | 10 | 20 | 35 | 50 | 65 | 75 | 90 | |
| μ ч-1 | 0,05 | 0,1 | 0,17 | 0,2 | 0,23 | 0,24 | 0,25 | ||||
| 21
| Eschericia coli | глюкоза
| S мг/л | 10 | 20 | 35 | 45 | 55 | 65 | 80 | |
| μ ч-1 | 0,08 | 0,16 | 0,28 | 0,35 | 0,38 | 0,42 | 0,43 | ||||
| 22
| Pseudomonas sp. | капролактам | S мг/л | 20 | 50 | 75 | 125 | 150 | 175 | 200 | |
| μ ч-1 | 0,2 | 0,42 | 0,56 | 0,64 | 0,67 | 0,68 | 0,7 | ||||
| 23
| Brevibacterium sp.
| нафталин | S мг/л | 10 | 30 | 60 | 85 | 105 | 125 | 150 | |
| μ ч-1 | 0,12 | 0,3 | 0,49 | 0,56 | 0,57 | 0,59 | 0,6 | ||||
| 24
| Arthrobacte rsp. | нафталин | S мг/л | 20 | 65 | 115 | 160 | 205 | 250 | 300 | |
| μ ч-1 | 0,02 | 0,05 | 0,08 | 0,09 | 0,1 | 0,11 | 0,11 | ||||
| 25
| Arthrobacte r sp.
| нафталин + 5%NaCl | S мг/л | 20 | 65 | 115 | 160 | 205 | 250 | 300 | |
| μ ч-1 | 0,02 | 0,054 | 0,1 | 0,12 | 0,13 | 0,14 | 0,14 | ||||
| 26
| Eschericia coli
| маннит
| S мг/л | 50 | 125 | 200 | 275 | 350 | 425 | 500 | |
| μ ч-1 | 0,05 | 0,11 | 0,14 | 0,17 | 0,18 | 0,19 | 0,2 | ||||
| 27
| Candida sp.
| глицерин
| S мг/л | 30 | 100 | 170 | 240 | 310 | 380 | 450 | |
| μ ч-1 | 0,07 | 0,16 | 0,22 | 0,27 | 0,31 | 0,33 | 0,34 | ||||
РАЗДЕЛ 5: МЕТОДЫ КОЛИЧЕСТВЕННОГО УЧЕТА МИКРООРГАНИЗМОВ
Лабораторная работа № 13






