Все щелочные металлы образуют одинаковую кристаллическую структуру. У щелочных металлов тип металлической структуры – объемно - центрированная кубическая упаковка (ОЦКУ).
| Координационное число равно 8. |

Общая характеристика элементов II - А группы
Be, Mg, Ca, Sr, Ba, Ra – элементыII А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами.
Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra.
Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь  ), за счет чего атомы могут быть двухвалентными.
), за счет чего атомы могут быть двухвалентными.
2s 2p
| Be [He] 2s2 Be* [He] 2s1 2p1 |
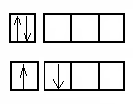
Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов.
У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка)
Ca, Sr – ГКУ (гранецентрированная кубическая упаковка)
Ba – ОЦКУ (объемно-центрированная кубическая упаковка)
Вопросы для самоконтроля
1. В чем заключается своеобразие строения атома водорода.
2. Физические и химические свойства атома водорода.
3. В чем заключается гидратация протона.
4. Гидриды щелочных и щелочно-земельных элементов.
5. Химические свойства воды.
6. Вода как растворитель и лиганд.
7. Сколько всего s -элементов (включая водород и гелий) периодической системе?
Литература:
1.Ахметов, Н.С. Общая и неорганическая химия: учебник /Н.С. Ахметов. - М.: Высшая школа, 2005.
2. Хомченко, Г.П. Неорганическая химия: учебник для с.-х. вузов / Г.П. Хомченко, И.К. Цитович. – СПб.: ИТК Гранит: ООО ИПК «КОСТА», 2009. – 464 с.
3. Цитович, И.К. Курс аналитической химии: учебник / И.К. Цитович.- СПб.: Лань, 2007.
4. Саргаев, П.М. Неорганическая химия [Электронный ресурс]/ П.М. Саргаев.- СПб.: Лань, 2013.- Режим доступа: http://www.Lanbook.ru, свободный.
ХИМИЯ P- ЭЛЕМЕНТОВ
Вопросы, на которые необходимо обратить внимание при изучении темы (по лекционному материалу и рекомендуемой литературе):
III-А – подгруппа. Отличие электронного строения атомов бора и алюминия от строения других элементов подгруппы. Физико-химические свойства бора и алюминия и их кислородсодержащих соединений.
IV-А – подгруппа. Особенности химических связей углеродуглерод, углерода с водородом, азотом и кислородом. Кислородсодержащие соединения углерода и кремния.
V-А – подгруппа. Особенности строения атомов подгруппы, соединения их с водородом, кислородом. Химия молекулярного азота и фосфора и их соединений с другими элементами. Особенности азота и фосфора как биогенных элементов.
VI-А – подгруппа. Особенности строения атомов подгруппы, соединения их с водородом, углеродом. VII-А – подгруппа. Электронное строение атомов галогенов и закономерности изменения свойств галогенов в подгруппе. Природа образуемых галогенами химических связей. Степени окисления галогенов в соединениях. Причины отсутствия в природе ковалентных соединений галогенов.
VIII-А – подгруппа. Строение электронных оболочек атомов благородных газов как причина их низкой химической активности. Важнейшие соединения благородных газов: фториды ксенона, криптона и радона, триоксиды ксенона и радона, перксенаты. Области применения благородных газов.
Вопросы темы, выносимые для самостоятельного изучения (сделать краткий конспект):
III-А – подгруппа. Оксиды и гидроксиды алюминия, амфотерность этих соединений, реакции превращений.
IV-А – подгруппа. Соединения углерода в питании человека. Особенности химии германия, олова, свинца, применение этих элементов и их соединений.
V-А – подгруппа.Специфика химических связей азота и фосфора в биомолекулах. Важнейшие азот- и фосфорсодержащие биомолекулы, их значение в деятельности растительных и животных клеток. Значение азота и фосфора как элементов питания. Особенности химии мышьяка, сурьмы, висмута, применение этих элементов и их соединений.
VI-А – подгруппа.Химия молекулярного кислорода и серы и их соединений с другими элементами. Особенности химии селена, теллура и полония, применение этих элементов и их соединений.
Экологическая роль кислорода и озона атмосферы. Применение сульфатов и других соединений серы в сельском хозяйстве. Кремнезем, силикаты, алюмосиликаты как почвообразующие материалы, их значение для плодородия почв ( по направлению «Агрономия»)
Пероксид водорода и другие пероксиды и надпероксиды.. Молекулярный кислород в биоэнергетике. Роль функциональных кислородсодержащих групп в биомолекулах.Сера как биогенный элемент. Экологическая опасность сернистого газа. Роль селена в питании человека и кормлении сельскохозяйственных животных. Особенность химии германия, олова и свинца, экологическая опасность свинца. (по направленияю: «Ветеринарно-санитарная экспертиза»).
VII-А – подгруппа.Химия молекулярного хлора и фтора и их соединений с другими элементами. Особенности хлора как биогенного элемента, роль хлора в живой клетке.Фтор как жизненно необходимый элемент и как элемент-загрязнитель окружающей среды. (по направленияю: «Ветеринарно-санитарная экспертиза»).
Применение соединений хлора в сельском хозяйстве (по направлению «Агрономия»)
VIII-А – подгруппа.Важнейшие соединения благородных газов: фториды ксенона, криптона и радона, триоксиды ксенона и радона, перксенаты. Области применения благородных газов.
В атомах р-элементов электроны заполняют р-подуровень внешнего уровня. В периодической системе есть 30 р-элементов. У атомов р-элементов, расположенных в главных подгруппах III - VIII групп. У р-элементов являются валентными не только р-, но и S-электроны внешнего уровня. Высшая степень окисления атомов р-элементов равна номеру группы.
Краткая характеристика p – элементов III-A группы
Элементы IIIА группы имеют электронную формулу ns2np1. Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3, и валентность 3. При образовании ковалентной связи происходит s®p возбуждение электрона и sp2 гибридизация АО. В группе сверху вниз растут металлические свойства элементов, растут восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства:
III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома.
III группа самая элементоемкая – содержит 37 элементов, включая лантаноиды и актиноиды. Все элементы - металлы, за исключением бора.
В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения большинства этих элементов, в которых их степень окисления +1, очень неустойчивы и наиболее характерна для них степень окисления +3 в возбужденном состоянии, т.к. на перевод электрона из s-состояния в р - надо немного энергии.
| 2s | 2p | |||||
| 5B 2s22p1 | ¯ | | (+1) | |||
| 5B 2s12p2 | | | ¯ | (+3) |
B – неметал, Al – еще не типичный металл, Ga, In, Tl –типичные металлы.
Образуют соединения с галогенами ЭГ3, серой Э2S3, азотом ЭN.
Краткая характеристика p – элементов IV - A группы
В IV-A группе находятся р - элементы C, Si, Ge, Sn, Pb. Конфигурация атома в невозбужденном состоянии ns2 nр2, в возбужденном состоянии ns1nр3, все 4 электрона неспаренные в этом состоянии для них характерна s1p3-гибридизация.
| 2s | 2p | |||||
| С 2s22p2 | ¯ | | | (+2) | ||
| С* 2s12p3 | | | | | (-4, +4) |
Радиусы атомов закономерно растут с увеличением порядкового номера, ионизационный потенциал соответственно уменьшается.
В большинстве неорганических соединений углерод и кремний проявляют степень окисления +4. Но от германия к свинцу прочность соединений со степенью окисления +4 уменьшается, более стабильна низкая степень окисления +2. Могут проявлять степени окисления - 4 в гидридах.
C - типичный неметалл
Si - типичный неметалл
Ge - есть металлические свойства
Sn - металлические свойства преобладают над неметаллическими
Pb - металлические свойства преобладают над неметаллическими
| Краткая характеристика p – элементовV-А группы |
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация п s2 п p3).
В соединениях элементы проявляют степень окисления от -3 до 5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.
При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.
Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.
Закономерно нарастает от N к Bi ионный радиус, но он много меньше атомного. Это связано с тем, что внешние электроны находятся на значительном расстоянии от ядра по сравнению с предвнешними, и когда атом теряет внешние электроны, переходит в ион, радиус иона соответственно ниже радиуса атома. Плотность закономерно нарастает.
Незакономерность изменения свойств (Tпл и Ткип) обусловлена особенностью строения кристаллической решетки. Если азот – это газ, то последний элемент группы находится в твердом агрегатном состоянии.
Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3.
NH3 аммиак
PH3 фосфин
AsH3 арсин
SbH3 стибин
BiH3 висмутин
AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.
Все элементы VА группы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4, которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3, у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3) гидролизуются по схеме:
ЭГ3 + 3Н2О = Н3ЭО3 + 3НГ
ЭCl3 + H2O = H3ЭО3 + 3НCl
Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком.
Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ (AsH3- арсин)
Краткая характеристика p – элементовVI-А группы
Элементы VI-A группы - это кислород, сера, селен, теллур и радиоактивный металл полоний. Кислород и сера – неметаллы. Полоний металл серебристо белого цвета, напоминающий по физическим свойствам свинец, селен и теллур, занимающие промежуточное положение, являются полупроводниками. Кислород, сера, селен, теллур – имеют неметаллический характер, называются «халькогены», т.е. образующие руды.
На внешнем уровне атомов этих элементов содержится 6 электронов: ns2 np4. В атомах элементов Se, Te и Po электроны внешнего уровня экранируются от ядра десятью d-электронами предвнешнего уровня, что ослабляет их связь с ядром и способствует проявлению металлических свойств этих элементов.
Особенность строения атома кислорода – отсутствие d-подуровня, поэтому валентность кислорода равна 2, но за счёт неподелённых электронных пар кислород может быть донором электронных пар.
8O[He] 2s22p4
У серы и остальных халькогенов возможен переход p и s-электронов в d–состояние. Поэтому валентность их может быть 2,4,6.
С увеличением порядкового номера халькогенов понижается окислительная активность нейтральных атомов и растёт восстановительная активность отрицательных ионов.
Краткая характеристика p – элементов VII -А группы
(Галогены)
Элементы фтор, хлор, бром, иод, астат составляют главную подгруппу VII группы – семейство галогенов (в переводе с греческого соль рождающие). Объясняется их способностью образовывать бинарные соединения типа NaCl за счёт проявления ими окислительных свойств.
На внешнем уровне у них 7 электронов ns2np5, электронная конфигурация обусловливает характерную степень окисления всех элементов в их соединениях (-1). В то же время для хлора, брома и иода известны соединения, где их степени окисления имеют положительные значения: +1, +3, +5, +7.
До завершения оболочки не достаёт 1 электрона. Поэтому галогены – сильные окислители. Это типичные неметаллы (за исключением At, и отчасти иода). Обладают большим сродством к электрону (сродство к электрону – энергия, которая выделяется при присоединении к атому одного электрона).
Легко присоединяют электрон Э + е- = Э- , достраивая электронную оболочку до устойчивой оболочки атомов ближайших благородных газов. Радиус иона больше радиуса атома, так как при присоединении электронов радиус увеличивается. Окислительная способность (т.е. способность присоединять электроны у галогенов уменьшается от F к At). Поэтому фтор вытесняет все следующие за ним галогены, у йода и астата появляются металлические признаки.
При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Наl2 - F2 , Cl2 , Br2 , I2.
Сила связи Э – Э уменьшается вниз по группе за исключением связи F – F, которая неожиданно слабее (причина этого, по-видимому, состоит в более близком расположении неподелённых электронных пар из-за малых размеров атома фтора, отталкивание неподелённых электронных пар ослабляет связь). В Cl2 , Br2 , I2 – дативная связь дополнительная, за счёт спаренных p-электронов одного атома и вакантных d-орбиталей другого.Такие дополнительные связи называются дативными и приводят к упрочнению молекулы.
Физические свойства галогенов существенно различаются: так, при нормальных условиях F2 – зеленовато – жёлтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании а организм вызывает отёк лёгких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей.
Cl2 – также газ желто – зеленого цвета, но сжижается легко; Br2 – красно- коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл). I2 – фиолетовые кристаллы. Для человека смертельная доза 2-3 г йода, но в форме иодид - ионов безвреден.
Галоводороды - летучие водородные соединения галогенов, хорошо растворимы в воде, ведут себя в водных растворах как кислоты. Сила кислот (способность к диссоциации на ионы) растёт сверху вниз, т. к. уменьшается прочность связи Н – Э в молекулах от F к At.
Литература:
1.Ахметов, Н.С. Общая и неорганическая химия: учебник /Н.С. Ахметов. - М.: Высшая школа, 2005.
2. Хомченко, Г.П. Неорганическая химия: учебник для с.-х. вузов / Г.П. Хомченко, И.К. Цитович. – СПб.: ИТК Гранит: ООО ИПК «КОСТА», 2009. – 464 с.
3. Цитович, И.К. Курс аналитической химии: учебник / И.К. Цитович.- СПб.: Лань, 2007.
4. Саргаев, П.М. Неорганическая химия [Электронный ресурс]/ П.М. Саргаев.- СПб.: Лань, 2013.- Режим доступа: http://www.Lanbook.ru, свободный.
Вопросы для самоконтроля
1. Сколько р-элементов находится в периодической системе Д.И.Менделеева?
2. Какой подуровень внешнего электронного уровня заполняется у р-элементов?
3. Чему равна высшая степень окисления у р-элементов?
4. Какую общую электронную формулу имеют р-элементы III A-группы?
5. Какую общую электронную формулу имеют р-элементы IV A-группы?
6. Какую общую электронную формулу имеют р-элементы V A-группы?
7. Какую общую электронную формулу имеют р-элементы VI A-группы?
8. Охарактеризуйте возможные валентности и степени окисления атомов р-элементов VI групп на примерах кислорода и серы.
ХИМИЯ D-ЭЛЕМЕНТОВ
Вопросы, на которые необходимо обратить внимание при изучении темы (по лекционному материалу и рекомендуемой литературе):
Положение d-элементов в периодической системе. Металлы побочных подгрупп (переходные металлы), их свойства. Энергетические подуровни, которые заполняются электронами в атомах переходных элементов. Общие свойства и особенности переходных металлов. Зависимость свойств переходных металлов от электронных структур s-, p-, d- и f-подуровней атомов. Химические особенности d-металлов, отличающие их от s- металлов. Разнообразие устойчивых при обычных условиях степеней окисления. Соединения, в которых d-металлы проявляют высшие степени окисления. Физико-химические свойства хрома, молибдена, марганца, железа, кобальта, никеля, меди и их соединений
Вопросы темы, выносимые для самостоятельного изучения (сделать краткий конспект):
Особенности химии биогенных d-металлов строение и свойства их важнейших соединений. Химические особенности f-элементов. Понятие микроэлементов. Хлорофилл (по направлению «Агрономия»)
Роль соединений хрома, молибдена, марганца, железа, никеля, меди и цинка в жизнедеятельности человека и животных; соединения железа в степенях окисления +2 и +3, соединения кобальта в степенях окисления +2 и +3; соединения никеля в степени окисления +2; соединения меди в степенях окисления +1 и +2; соединения цинка, кадмия и ртути; роль соединений хрома, молибдена, марганца, железа, никеля, меди и цинка в жизнедеятельности человека и животных; токсичность соединений кадмия и ртути. Гемоглобин(по направленияю: «Ветеринарно-санитарная экспертиза»).
Краткая характеристика D – элементов
В атомах d-элементов (переходных элементов) заполняется электронами d-подуровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро- и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
Литература:
1.Ахметов, Н.С. Общая и неорганическая химия: учебник /Н.С. Ахметов. - М.: Высшая школа, 2005.
2. Хомченко, Г.П. Неорганическая химия: учебник для с.-х. вузов / Г.П. Хомченко, И.К. Цитович. – СПб.: ИТК Гранит: ООО ИПК «КОСТА», 2009. – 464 с.
3. Цитович, И.К. Курс аналитической химии: учебник / И.К. Цитович.- СПб.: Лань, 2007.
4. Саргаев, П.М. Неорганическая химия [Электронный ресурс]/ П.М. Саргаев.- СПб.: Лань, 2013.- Режим доступа: http://www.Lanbook.ru, свободный.






