Количественными характеристиками процессов гидролиза являются степень гидролиза (h) и константа гидролиза (K Г).
Степень гидролиза –отношение количества прогидролизовавшейся соли к общему количеству соли в растворе:
 .
.
Константа гидролиза –константа равновесия процесса гидролиза.
Выражение константы гидролиза в общем виде можно записать через ионное произведениеводы и константу диссоциации образующегося слабого электролита:
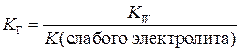 .
.
Рассмотрим гидролиз соли CH3COONa:

CH3COONa = CH3COO– + Na+ (диссоциация в растворе)
Гидролизу подвергается анион слабой кислоты:
CH3COO– + H2O DCH3COOH + OH–
В молекулярной форме:
CH3COONa + H2O DCH3COOH + NaOH
Выражение константы гидролиза имеет следующий вид:
 .
.
Гидролиз соли CuCl2 протекает по следующей схеме:

CuCl2 = Cu2+ + 2Cl– (диссоциация в растворе)
Cu2+ + H2O DCuOH+ + H+
Гидролиз этой соли протекает преимущественно по I ступени и образующимся слабым электролитом является катион CuOH+.
Выражение константы гидролиза имеет следующий вид:
 .
.
В молекулярной форме уравнение гидролиза имеет вид:
CuCl2 + H2O D CuOHCl + HCl
Константу гидролиза соли, образованной слабой кислотой и слабым основанием, можно записать следующим образом:
 .
.
Степень гидролиза с константой гидролиза связана выражением:
 .
.
Для случая, когда степень гидролиза мала (h << 1), получаем
 или
или 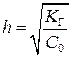 .
.
Важной характеристикой процессов гидролиза является pH среды. Растворы средних солей, образованных слабыми кислотами и сильными основаниями, имеют щелочную реакцию среды (pH > 7), растворы средних солей, образованных сильными кислотами и слабыми основаниями, – кислую (pH < 7). Если соль образована слабой кислотой и слабым основанием, характер среды определяется электролитом, у которого константа диссоциации больше.
В некоторых случаях необходимо рассчитать pH раствора. Концентрацию ионов, накапливающихся в растворе (H+ или OH–), можно найти по формуле
 ,
,
если 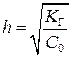 , тогда
, тогда  , или
, или  .
.
Зная 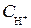 или
или  , можно определить pH раствора.
, можно определить pH раствора.
Пример 1. Вычислите константу гидролиза, степень гидролиза и pH 0,2 М раствора Na2SO3.
Решение. Рассмотрим гидролиз раствора Na2SO3.


 (диссоциация в растворе)
(диссоциация в растворе)
Гидролизу подвергается анион слабой кислоты:
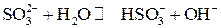 (I ступень),
(I ступень),
В молекулярной форме:
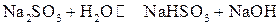
Константу гидролиза рассчитываем, используя формулу
 ,
,
где KW – величина постоянная, равная 10–14; K слабых электролитов – табличные значения [15]. Тогда
 .
.
Поскольку константа гидролиза невелика (<10–5), для расчета степени гидролиза воспользуемся следующей формулой:
 .
.
Для определения pH раствора нужно вычислить равновесную концентрацию ионов OH– в растворе, образующихся в результате гидролиза Na2SO3:
 или
или  ;
;
 моль/л, тогда
моль/л, тогда


Пример 2. Рассчитайте константу гидролиза цианида аммония.
Решение. Рассмотрим гидролиз раствора NH4CN:

 (диссоциация в растворе)
(диссоциация в растворе)
Гидролизу подвергается катион слабого основания и анион слабой кислоты. Цианид аммония гидролизуется практически полностью:

В молекулярной форме:

Константу гидролиза находим по формуле
 .
.






