Веществ из суппозиториев методом растворения
В цилиндрах
Суппозитории помещают в стеклянные цилиндры, содержащие по 10 мл воды очищенной, t = 37 °С, плотно закрывают и помещают в термостат на 10 мин. Каждые 2 мин цилиндры встряхивают 5 раз. По истечении 10 мин цилиндры вынимают из термостата, погружают в холодную воду и после застывания суппозиторной массы сливают жидкую часть: раствор, эмульсию, суспензию. В цилиндры, содержащие суппозиторную массу, вновь заливают 10 мл воды и все операции повторяют 3-4 раза. В сливе определяют количественное содержание лекарственного вещества химическим или физико-химических методом. Метод позволяет выбрать оптимальную основу и технологию изготовления суппозиториев.
Комбинированный метод
Предложен прибор с проточной камерой и замкнутой системой циркуляции диализата для определения скорости высвобождения лекарственных веществ из суппозиториев (рис. 32).
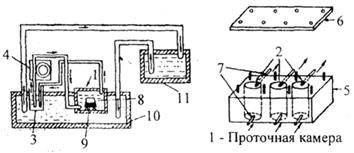
Рис. 32. Схема прибора для определения скорости высвобождения
лекарственных веществ из суппозиториев (объяснение в тексте)
[Б.Л. Молдавер, 1981].
Основной частью прибора является проточная камера 1 с тремя гнездами 2, каждое из которых гибкими резиновыми трубками сечением 2 мм соединено с сосудом 3, содержащим жидкость для диализа, через перистальтический насос 4, обеспечивающий циркуляцию диализата с постоянной скоростью (15 мл/мин). Проточная камера состоит из корпуса 5 с тремя цилиндрическими гнездами диаметром 5 см и высотой 4 см, крышки 6, которая герметично закрывает гнезда камеры с помощью 8 болтов с гайками. Гнезда имеют входное и выходное отверстия со штуцерами 7, на которые закрепляются гибкие резиновые трубки. Внутрь гнезд помещают диализные ячейки 8, представляющие собой стеклянные конические сосуды высотой 3 см, диаметром дна 2,5 см и диаметром отверстия 3,5 см. Отверстие сосуда затягивают герметично закрепляемой полупроницаемой мембраной 9 из целлофана марки С-100, применяемого в аппарате «искусственная почка» (ТУ 6-517-18-71). На мембрану перед её закреплением помещают равномерным слоем исследуемые суппозитории или суппозиторную основу (контроль) массой 2 г. В качестве диализной жидкости используют 100 мл воды. Температуру жидкости внутри проточной камеры и стаканчика с диализатом поддерживают с помощью термостатируемой камеры 10 и термостата 11 на уровне 37 °С. После начала диализа пробы диализата для анализа отбирают через 10, 20, 30, 40, 50, 60, 80, 100, 120, 150, 180 мин, добавляя каждый раз после взятия пробы равное количество воды. В охлажденных пробах диализата определяют концентрацию вещества спектрофотометрическим методом, используя в качестве контроля диализат основы. Все опыты проводятся в 6-кратной повторности.
Метод позволяет выбрать рациональное сочетание основообразующих и вспомогательных компонентов и технологию изготовления суппозиториев.
Заключение
Необходимо отметить, что любой метод исследования фармацевтической доступности действующего вещества в условиях in vitro представляет собой ценность только тогда, когда он дает результаты, коррелирующие с опытами in vivo. Тем самым, создавая новые лекарственные препараты, важно проводить биофармацевтические исследования, рассматривая при этом совокупность факторов, оказывающих влияние на БД действующего вещества и используя при этом новые тесты и методы аналитического контроля ЛВ.
Задание для студентов
1. Изучить теоретический материал разделов учебно-методического пособия.
2. Ответить на контрольные вопросы.
3. Назвать оригинальные препараты приведенных в таблице воспроизведенных лекарственных препаратов.
| Оригинальный лекарственный препарат | Воспроизведенный лекарственный препарат |
| Дротаверина гидрохлорид | |
| Пентоксифиллин-акри | |
| Винпоцетин | |
| Эналаприл | |
| Энап (КРКА) | |
| ацетилсалициловая кислота | |
| азитромицин | |
| ципрофлоксацин | |
| кларитромицин | |
| пироксикам |
4. Назвать воспроизведенные лекарственные препараты
| Оригинальный лекарственный препарат | Воспроизведенный лекарственный препарат |
| Но-шпа | |
| Кларидин | |
| Ренитек | |
| Ламизил | |
| Кавинтон | |
| Трентал | |
| Клацид | |
| Сумамед | |
| Рулид | |
| Ноотропил | |
| Беротек | |
| Вентолин |
5. Изучить эталон решения ситуационной задачи и решить задачи по заданию преподавателя.
6. Изучить тестовые задания и ответить на вопросы тестового задания в компьютерном классе.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Понятие эквивалентности лекарственных препаратов. Виды эквивалентности.
2. Химическая эквивалентность. Определение. Мера химической эквивалентности.
3. Фармацевтическая эквивалентность. Определение. Мера фармацевтической эквивалентности.
4. Биологическая эквивалентность. Определение. Мера биологической эквивалентности.
5. Терапевтическая эквивалентность. Определение. Мера терапевтической эквивалентности.
6. Оригинальные и воспроизведенные лекарственные препараты. Понятие. Примеры лекарственных препаратов.
7. Генерические лекарственные препараты.
8. Биологическая доступность как мера биологической эквивалентности лекарственных препаратов.
9. Методы определения БД: фармакодинамический и фармакокинетический.
10. Абсолютная и относительная БД Особенности определения.
11. Методы оценки биологической доступности на живых объектах.
12. Схема определения БД при однократном введении препарата.
13. Схема определения БД при многократном введении препарата.
14. Определение биологической доступности на людях Правила GCP.
15. Определение биологической доступности на животных Правила GLР.
16. Понятие фармацевтической доступности.
17. Тесты «Растворения» и «Распадаемости» как первый этап определения БД.
18. Статические методы определения скорости растворения.
19. Динамические методы определения скорости растворения.
20. Тест «Растворение» как метод оценки качества лекарственных препаратов.
21. Историческое развитие теста»Растворение» как метода оценки качества лекарственных препаратов.
22. Методика проведения теста «Растворение» по фармакопее США.
23. Тест «Высвбождение» лекарственных веществ из лекарственных форм продленного действия и систем трансдермальной доставки.
24. Методика определения распадаемости лекарственных форм по ГФ.
25. Аппараты для проведения испытаний твердых лекарственных форм по ОФС 42-0003-04 «Растворение»
26. Методики проведения испытаний кишечнорастворимых твердых лекарственных форм по ОФС 42-0003-04 «Растворение».
27. Интерпретация результатов исследования таблеток, капсул и таблеток, покрытых оболочкой по ОФС 42-0003-04 «Растворение».
28. Интерпретация результатов исследования кишечнорастворимых твердых лекарственных форм по ОФС 42-0003-04 «Растворение».
29. Интерпретация результатов исследования твердых лекарственных форм с модифицированным высвобождением по ОФС 42-0003-04 «Растворение».
30. Методы определения скорости растворения при «нулевой» концентрации.
31. Диализная установка для изучения фармацевтической доступности лекарственных веществ.
32. Экстракционная ячейка или лопасть над диском.
33. Принципы определения скорости растворения в автоматизированной модели распределения Rеsomat I.
34. Принципы определения скорости распределения модельной системе Resotest.
35. Принципы определения скорости абсорбции in vitro автоматизированной мембранной модели Resomat II.
36. Принципы определения скорости растворения, распределения и транспорта в автоматизированной модельной системе Sartorius.
37. Методы определения скорости и степени высвобождения лекарственных веществ из мягких лекарственных форм.
38. Метод окрашенных комплексов для биофармацевтической оценки мазей с водо- и жирорастворимыми компонентами.
39. Метод микроскопии для биофармацевтической оценки мазей-суспензий.






