Распределения и всасывания находящиеся
В стадии разработки
Bhavnagri V.P. и Speiser P. предложили модельную систему, которая пригодна для изучения растворения и транспорта как пероральных так и ректальных лекарственных форм (рис.29). Донорный компонент имеет объем 7,5 см3, акцепторный компонент – 250 см3, мембрана из ацетата целлюлозы площадью 19 см2. Движение фаз осуществляется посредством вибрации.

Рис. 29. Модель всасывания по Bhavnagri и Sptiser
(М – магнитный вибратор, Е – впускное отверстие) [Г.С. Киселева, 1992]
Рабочая группа ученых, возглавляемая Furst W. и Neubert R. предложила модельную систему, сконструированную по параметрам оценки биологической доступности.
Установка (рис.30) состоит из ДК объемом 50 см3 и АК – 400 см3. Мембранная площадь составляет 160 см2, донорный компонент с обеих сторон ограничивается мембранами. В качестве мембран большей частью были использованы Dodecanol – Collodium – мембраны. Движение раствора осуществляется путем умеренной вибрации. При помощи модельной системы одновременно можно проводить 4 опыта. При помощи этой модельной системы уже были исследованы пероральные лекарственные формы большинства лекарственных веществ.
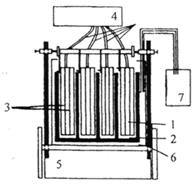
Рис. 30. Модель всасывания по Furst и Neubert (1 – донорный компонент,
2 – акцепторный компонент, 3 – мембрана, 4 – насос-дозатор, 5 – вибратор,
6 – водяная баня, 7 – термостат) [Г.С. Киселева, 1992]
10. СПЕЦИФИЧЕСКИЕ МЕТОДЫ
БИОФАРМАЦЕВТИЧЕСКОЙ ОЦЕНКИ МЯГКИХ
ЛЕКАРСТВЕННЫХ ФОРМ
Оценка высвобождения лекарственных веществ из мазей и суппозиториев, как правило, направлена на определение способности основы высвобождать лекарственные вещества. В данном случае применимы методы, позволяющие провести качественную и количественную оценку высвободившихся веществ, в которых среда имитирует кожу или слизистую оболочку.
Методы, применяемые для биофармацевтической оценки мягких лекарственных форм классифицируют:
• по явлению, лежащему в основе метода;
• по способу определения высвободившегося вещества.
По явлению, лежащему в основе метода, выделяют методы диализа, диффузии, окрашенных комплексов, микроскопии и метод растворения.
По способу определения высвободившегося вещества выделяют способы с химическим, физико-химическим и микробиологическим определением высвободившегося вещества.
Специфическими методами биофармацевтической оценки мягких лекарственных форм являются методы диффузии (в жидкую среду или в гель), окрашенных комплексов, микроскопии и метод растворения. Методика проведения диализа при биофармацевтической оценке мягких лекарственных форм не отличается от вышеприведенной.
Диффузия в жидкую среду
Образец мази наносят на определенную площадь, обозначенную на фильтровальной бумаге. Фильтровальную бумагу помещают в чашку Петри, в которой находится индикатор. Закрытая чашка Петри помещается в термостат при температуре 32-37 °С. Через определенные промежутки времени фиксируют радиус окрашенной зоны. Показателем являются результаты измерений зон высвобождения вещества или результаты количественного определения химическим или физико-химическим методом после элюирования окрашенной зоны. На основании сравнения результатов выбирают оптимальную основу или вариант технологии изготовления.
Диффузия в гель
2% агаровый или 4-10 % желатиновый гель готовят на стандартном растворителе (натрия хлорида 8,9 г, калия хлорида – 0,3 г, кальция хлорида – 0,33 г, дистиллированной воды до 1000 мл). Приготовленный раствор в количестве 15-20 мл разливают в чашки Петри. В сформировавшемся геле через 24 часа металлическим цилиндром с диаметром примерно 8 мм вырезают диски; в образовавшиеся лунки вносят испытуемые образцы лекарственных форм. Степень высвобождения препарата из лекарственной формы фиксируется по радиусу окрашенной зоны, которая образуется при взаимодействии вещества со специально подобранным индикатором. Индикатор вводится либо в процессе приготовления геля, либо наносится разбрызгиванием на поверхность чашки через определенное время контакта геля с лекарственной формой. Можно также вырезать определенную зону геля и после растворения провести количественное определение. В случае флюоресцирующих препаратов, зону их освобождения отмечают при просмотре в УФ – свете. Возможно также использование авторадиограмм и микробиологических тестов. В данном эксперименте показателями являются результаты измерения зон высвобождения препарата или результаты количественного определения. На основании сравнения результатов выявляют оптимальные технологические варианты и состав основы.






