- осмос определяет высокое содержание воды в внутриклеточном и межклеточном веществе
вода же в клетках и межклеточном веществе – необходимое условие нормального обмена веществ
- осмотическое давление внутриклеточных р-ров определяет упругость или тургор клеток и тканей
- биологические жидкости создают осмотическое давление за счет растворенных в них в-в
осмотическое давление удерживает р-тель в р-ре и «засасывает» р-тель из менее концентрированного р-ра
гидравлическое давление р-ра действует в противоположном направлении
осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением
онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением
онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано
при болезнях этот баланс нарушается
ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
- клетки в гипертоническом р-ре теряют внутриклеточную воду и сморщиваются - происходит плазмолиз клеток
- клетки в гипотоническом р-ре набухают до разрыва клеточной оболочки - происходит лизис клеток
- при запорах применяют
Солевые слабительные
ПР: глауберова соль Na2SO4*10H2O
действие солевых слабительных основано на образовании в просвете кишечника р-ра концентрированных солей,
которые сами плохо всасываются, а за счет высокого осмотического давления активно поглощают воду из..
в итоге, объем каловых масс увеличивается, и активизируется перистальтика кишечника
Онкотическое давление
осмотическое давление р-ра за счет растворенных белков называется онкотическим давлением
онкотическое давление р-ров, насыщенных белками, соизмеримо с их гидравлическим давлением
онкотическое и гидравлическое давление биологических жидкостей в организме сбалансировано
при болезнях этот баланс нарушается
ПР: если при болезни уменьшается содержание белков в крови,
то вода уходит из крови в межклеточное в-во тканей – ткани отекают, возникают отеки
электролиты, неэлектролиты,электролитическая диссоциация
существуют в-ва-электролиты и в-ва-неэлектролиты:
электролиты - в-ва, растворы(расплавы) которых пропускают е-ток
ПР: NaCl, NaOH
неэлектролиты – в-ва, растворы(расплавы) которых не пропускают е-ток
ПР: метан, сахар, О2
электролитическая диссоциация - распад электролитов на ионы
ПР: NaCl ® Na+ + Cl-
HCl ® H+ + Cl-
NaOH ® Na+ + OH-
теория электролитической диссоциации
*1887 Аррениус "теория электролитической диссоциации" *Менделеев, Каблуков ”кристаллогидраты и гидраты”
1) при растворении в воде(расплавлении) молекулы электролитов распадаются на ионы
распад электролитов на ионы есть электролитическая диссоциация
ПР: NaCl ® Na+ + Cl-
HCl ® H+ + Cl-
NaOH ® Na+ + OH-
полные уравнения показывают гидраты ионов - соединения ионов с водой в водном р-ре
NaCl + nH2O ® Na+*zH2O + Cl-*mH2O
HCl + nH2O ® H3O+ + Cl-*nH2O
NaOH + nH2O ® Na+*nH2O + OH-
2) электролиты - в-ва, распадающиеся в растворе(расплаве) на ионы
хим.связь в молекуле электролитов ионная или полярная ковалентная
3) неэлектролиты - в-ва, не распадающиеся в растворе(расплаве) на ионы
хим.связь в молекуле неэлектролитов неполярная ковалентная или малополярная ковалентная
4) при распаде молекул образуются ионы с (+)зарядом катионы и ионы с (-)зарядом анионы
в растворе(расплаве) ионы движутся хаотически
5) растворы(расплавы) электролитов проводят электрический ток
при пропускании e-тока катионы движутся к катоду(электроду-), анионы движутся к аноду(электроду+)
6) электролитическая диссоциация – процесс обратимый (для слабых электролитов)
одновременно с диссоциацией молекул на ионы идет ассоциация ионов в молекулы
между диссоциацией и ассоциацией устанавливается динамическое равновесие
ПР: H2O Û H+ + OH-
механизм электролитической диссоциации веществ с ионной и ковалентной полярной связью
роль растворителя в процессе диссоциации
диссоциация идет по стадиям:
1) гидратация в виде упорядоченного расположения диполей воды вокруг молекул-ионов электролита
2) если связи в молекуле электролита только полярные, то они становятся ионными
происходит поляризация молекул электролита
3) диссоциация молекул-ионов электролита
4) обратная рекомбинация ионов тормозится гидратными оболочками
на всех стадиях диссоциации принимают участие молекулы растворителя
ПР:  процесс диссоциации веществ(в-в с полярными связями) в воде
процесс диссоциации веществ(в-в с полярными связями) в воде
HCl полярная ковалентная связь
в-во находится в растворенном виде,
в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно,
взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной
взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-,
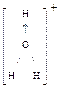 образуются ионы Cl-_и Н+ (свободно не существуют)
образуются ионы Cl-_и Н+ (свободно не существуют)
физическая фаза ® химическая фаза:
в электрическом поле ионов Н+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)

NaCl ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и Cl- и диполей Н2О ослабляет связи Na+-Cl-,
образуются ионы Na+ и Cl- (одновременно идет растворение и диссоциация)
физическая фаза ® химическая фаза:
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и Сl-

NaОН ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-,
образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация)
физическая фаза ® химическая фаза:
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и гидроксид-ионы ОН-
329)степень диссоциации. зависимость степени диссоциации от различных факторов
330) экспериментальное определение степени диссоциации.
активность электролитической диссоциации характеризуется степенью электролитической диссоциации,
степень электролитической диссоциации a рассчитывается по формуле
a = n / N,
где n - число диссоциированных молекул, N - общее число молекул
экспериментальное определение степени диссоциации,
расчёт степени диссоциации по изотоническому коэффициенту
зависимость степени диссоциации от различных факторов
на степень электролитической диссоциации влияют:
- природа растворителя
чем полярнее молекулы р-теля и больше его диэлектрическая проницаемость, тем сильнее диссоциация
- природа в-ва
чем полярнее молекулы в-ва, тем сильнее диссоциация
- концентрация раствора (для слабых электролитов)
при снижении концентрации раствора степень электролитической диссоциации увеличивается
- температура
при нагревании степень электролитической диссоциации увеличивается






