значение диффузии в биологических процессах:
- скорость обмена в-в зависит как от скорости реакций обмена в-в, так от скорости движения реагирующих в-в
движение реагирующих веществ в клетках и межклеточном в-ве обусловлено диффузией
скорость движения реагирующих веществ в клетках и межклеточном в-ве определяется скоростью диффузии
- питательные вещества и продукты обмена в межклеточном в-ве и в клетках перемещаются путем диффузии
- диффузия лежит в основе пассивного транспорта веществ через клеточные мембраны
различают простую диффузию, ограниченную диффузию, облегченную диффузию
облегченная диффузия служит для транспорта крупных ионов и молекул или молекул жиронерастворимых в-в
для них из-за большого размера транспорт ч/з клеточные поры невозможен
путь транспорта – ч/з мембрану белками-переносчиками (транслоказами)
на внешней стороне мембраны вещество и транслоказы образуют комплексное соединение SX
комплексное соединение SX жирорастворимо и диффундирует в липидах мембраны
на внутренней стороне мембраны комплексное соединение SX распадается, и в-во попадает внутрь клетки
ПР: транспорт углеводов и аминокислот
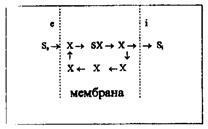
е - наружная часть клеточной мембраны, i - внутренняя часть клеточной мембраны,
S – углевод, Х – транслоказа
разные углеводы конкурируют за переносчика
ПР: глюкоза имеет большее сродство к переносчику и переносится лучше, чем другие углеводы
разные аминокислоты конкурируют между собой, но не конкурируют с углеводами(у них разные переносчики)
есть вещества- ингибиторы, которые тормозят транспорт углеводов и аминокислот в клетку
ингибиторы образуют соединения с транслоказами, которые в таком виде не участвуют в транспорте веществ
облегченная диффузия углеводов внутрь клетки рассчитывается по уравнению Михаэлиса-Ментен
 |
, где Ig - поток углеводов,
[ Se ] - концентрация углеводов снаружи клетки,
a - коэффициент доступности внутриклеточной воды,
b - сродство углевода к переносчику
кроме пассивного транспорта есть активный транспорт веществ через клеточные мембраны
активный транспорт требует энергии АТФ и служит для транспорта веществ против градиента концентраций
ПР: активный транспорт ионов Nа+ и К+
активный транспорт ионов Nа+ и К+ происходит путем хим.реакций в клеточной мембране (К-Nа насос)
в клеточной мембране есть белок «С» или «К-Nа-активируемая АТФ-аза», который
на внешней поверхности мембраны связывает ионы К+ внешней среды С + К+ ® С-К+
переносит их на внутреннюю поверхность мембраны
на внутренней поверхности мембраны освобождает К+ С-К+® С + К+
подвергается фосфорилированию С + АТФ ® СФ + АДФ
связывает ионы Nа+ внутри клетки СФ + Na+ ® СФ-Na+
соединение СФ-Na+ переносит Na+ на внешнюю поверхность мембраны
на внешней поверхности мембраны освобождает Na+ СФ-Na+® СФ + Na+
подвергается дефосфорилированию СФ ® С + Ф
связывает ионы К+ внешней среды С + К+ ® С-К+..
«К-Nа насос» работает как система двух согласованных циклов
первый цикл - ионообменный
второй цикл - реакции фосфорилирования и дефосфорилирования
активный транспорт Nа+ и К+ идет против концентрационного градиента
К+ внутри клетки в 40 раз больше, чем снаружи, Na+ вне клетки в 10 раз больше, чем внутри
энергия для выполнения этой работы образуется в результате общей реакции АТФ ® АДФ + Ф
«NaK-насос» обеспечивает одновременный транспорт 3Na+ и 2К+ на каждую молекулу АТФ

i - внутренняя сторона мембраны клетки,
e - наружная сторона мембраны клетки,
IСФNa - перенос ионов Nа+ от внутренней к наружной стороне мембраны,
IСК - перенос ионов К+ от наружной к внутренней стороне мембраны
роль диффузии в работе аппарата "искусственная почка"
«искусственная почка» – аппарат очищения крови или аппарат гемодиализа
диализ происходит путем диффузии продуктов обмена ч/з полупроницаемую мембрану:
мембрана пропускает низкомолекулярные вещества – мочевину, мочевую кислоту, амины, билирубин..
мембрана не пропускает клетки крови, белки..
артериальная кровь больного поступает в камеры аппарата и, пройдя по камерам, в/венно вливается больному
камеры имеют стенки из полупроницаемого материала и омываются раствором-диализатором
низкомолекулярные вещества диффундируют по градиенту концентраций из крови ч/з мембрану в р-р-диализатор

Осмос.
Полупроницаемые мембраны.
317) осмотическим давлением.
одни полупроницаемые мембраны проницаемы для растворенных в-в, другие - для молекул растворителя
если мембрана пропускает только молекулы растворителя, то наблюдается осмос
осмос – диффузия молекул растворителя из области низкой концентрации р-ра в область высокой концентрации
в направлении увеличения энтропии системы
диффузия р-теля идет в обоих направлениях, но преимущественно в область высокой концентрации р-ра
в результате осмоса объем концентрированного раствора увеличивается и его концентрация снижается
происходит выравнивание концентрации р-теля в обоих р-рах
происходит выравнивание диффузии р-теля в обоих направлениях - устанавливается равновесие
р-тель, переходящий из области низкой концентрации р-ра в область высокой концентрации, создает давление
такое давление назвали осмотическим давлением
чем больше концентрация р-ра, тем выше осмотическое давление р-ра
если к р-ру высокой концентрации приложить внешнее давление, равное осмотическому, то осмос остановится
в этом случае внешнее давление – мера осмотического давления
каждый раствор характеризуется осмотическим давлением по отношению к раствору чистого растворителя
317)закон Вант-Гоффа для идеальных растворов - разбавленных р-ров неэлектролитов
осмотическое давление пропорционально молярной концентрации р-ра и температуре
p = C × RT или p = n / V × RT или p V = n × RT уравнение похоже на уравнение Менделеева-Клайперона,
где p – осмотическое давление,
C - молярная концентрация,
R - газовая постоянная,
T - абсолютная температура,
V – объем раствора,
n - число молей неэлектролита
анализ уравнения:
- при равных концентрациях и температуре р-ры разных в-в создают одинаковое осмотическое давление
- для осмотического давления важно число частиц, размеры частиц значения не имеют
318)осмомоляльность. осмомолярность .осмометрия.
осмомоляльность – моляльная концентрация всех осмотически активных частиц в растворе в моль/кг
осмомолярность – молярная концентрация всех осмотически активных частиц в растворе в моль/л
осмометрия – измерение осмотического давления
различают прямой и косвенный методы измерения осмотического давления:
прямой метод
за счет осмоса в раствор переходит избыток р-теля
избыток растворителя имеет вид столбика жидкости в вертикальной трубке
столбик жидкости в вертикальной трубке создает гидростатическое давление
гидростатическое давление избытка р-теля равно осмотическому давлению раствора
косвенный метод
если к р-ру высокой концентрации приложить внешнее давление, равное осмотическому, то осмос остановится
прекращение осмоса замечают по прекращению изменения объемов растворов
в этом случае приложенное внешнее давление равно осмотическому давлению р-ра
319)физиологический раствор, изотонические – растворы с одинаковым осмотическим давлением
осмотическое давление крови человека при 37°С равно 7,7 атм
физиологический раствор – 0,9% раствор NaCl, который изотоничен крови
физраствор применяется как кровезаменитель при кровопотере и как растворитель при введении лекарств
320) гипотонический,гипертонический – раствор, у которого осмотическое давление выше
гипертонические растворы применяются для лечения гнойных ран
ток раневой жидкости из раны в повязку очищает рану от гноя..
гипотонический – раствор, у которого осмотическое давление ниже
гипотонические растворы применяются для лечения обезвоживания организма
ток воды из крови в клетки и межклеточное вещество восполняет потери воды






