коллигативные – «общие» свойства
коллигативные - свойства растворов неэлектролитов «общие» для всех растворов
коллигативные свойства не зависят от природы неэлектролита
коллигативные - свойства растворов неэлектролитов, если эти растворы рассматривать как идеальные
при этом при вычислении одного коллигативного параметра определяются другие параметры
ПР: давление насыщенного пара,
температура кипения и температура замерзания,
осмотическое давление
- давление насыщенного пара р-теля над чистым р-телем выше, чем давление насыщенного пара р-теля над р-ром
р 0> р
в-во, занимая часть объема р-ра, снижает концентрацию р-теля
р-тель меньшей концентрации создает меньшее давление насыщенного пара р-теля над р-ром
есть разность давления насыщенного пара р-теля над чистым р-телем и давления насыщенного пара р-теля над р-ром
D р = р 0– р
314)эбуллиоскопическая и криоскопическая константа309) закон Рауля для идеального
раствора
разность давления насыщенного пара растворителя пропорциональна мольной доле растворителя в растворе
D р = К× cр-теля, где К – постоянная Рауля,
c р-теля - мольная или молярная доля растворителя
относительная разность давления насыщенного пара р-теля равна мольной доле растворенного в-ва
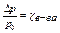 |
- Ткип чистого растворителя ниже, чем Ткип раствора ПР: Ткип водных растворов выше 100°С
кипение – испарение, которое идет и на поверхности, и внутри жидкости
кипение начинается, когда давление насыщенного пара уравнивается с атмосферным давлением
температура начала кипения – температура кипения Ткип
если испарение при кипении – равновесное состояние системы жидкость Û газ,
то влияние внешних факторов оценивается по принципу Ле-Шателье:
если у раствора снижается давление насыщенного пара,
то р-р придется дополнительно нагреть, чтобы повысить давление пара до восстановления равновесия
разность температуры кипения чистого р-теля и р-ра пропорциональна моляльной концентрации раствора
D t = Е× C для идеального раствора,
где Е – эбулиоскопическая константа,равная разности температуры кипения при единичной концентрации р-ра
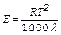 эбулиоскопическая константа зависит от удельной теплоты испарения р-теля и рассчитывается по формуле
эбулиоскопическая константа зависит от удельной теплоты испарения р-теля и рассчитывается по формуле
, где l - удельная теплота испарения растворителя в../г
эбулиометрия – метод определения разности температуры кипения растворов и растворителя
по разности температуры кипения раствора и растворителя определяют моляльную концентрацию раствора
- Тзамерз чистого растворителя выше, чем Тзамерз раствора ПР: Тзамерз водных растворов ниже 0°С
если плавление – равновесное состояние жидкость Û твердое тело,
то влияние внешних факторов оценивается по принципу Ле-Шателье:
если у раствора концентрация р-теля снижается – значит равновесие жидкость Û твердое тело смещается,
активируется процесс плавления, который останавливается при более низкой температуре
температура начала плавления или начала кристаллизации(замерзания) – температура замерзания Тзамерз
разность температуры замерзания пропорциональна моляльной концентрации раствора
D t = К× C для идеального раствора,
где К – криоскопическая константа, равная разности температуры плавления при единичной концентрации р-ра
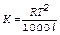 криоскопическая константа зависит от удельной теплоты плавления р-теля и рассчитывается по формуле
криоскопическая константа зависит от удельной теплоты плавления р-теля и рассчитывается по формуле
, где l – удельная теплота плавления растворителя в../г
криометрия – метод определения разности температуры кипения растворов
по разности температуры плавления раствора и растворителя определяют моляльную концентрацию раствора
по температурам кипения и замерзания раствора рассчитывают молекулярную массу растворенного вещества
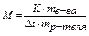 | |||
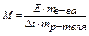 | |||
Диффузия
диффузия – взаимное проникновение молекул-атомов-ионов одних веществ между молекулами-атомами-ионами других
в результате теплового(броуновского) движения молекул-атомов-ионов
в направлении увеличения энтропии системы
диффузия наблюдается у газов-жидкостей-твердых тел
в растворах за счет диффузии происходит выравнивание концентрации в-в:
в-во из области высокой концентрации перемещается в область низкой концентрации
концентрационный градиент
при диффузии вещество из области высокой концентрации перемещается в область низкой концентрации
разность концентраций С двух точек, отнесенная к расстоянию х между ними, есть концентрационный градиент
D С / D х = grad С
Закон Фика
304)коэффициент диффузии для диффузии в растворах, не разделенных мембранами
скорость диффузии пропорциональна концентрационному градиенту и площади, через которую идет диффузия
dn /dt = - D × S × grad С,
где D - коэффициент диффузии в м2/сек,
S - площадь, через которую идет диффузия
dn /dt – скорость диффузии в количестве молей переносимого в-ва за единицу времени (моль/сек)
анализ уравнения:
скорость диффузии тем больше – чем больше коэффициент диффузии-градиент концентрации-площадь мембраны
*А.Эйнштейн М.Смолуховский предложили формулу расчета коэффициента диффузии
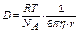 |
, где R – универсальная газовая постоянная R =8,31 Дж/моль × К,
Т – абсолютная температура в К,
NA - постоянная Авогадро NA =6,02 × 1023 моль-1,
h - вязкость среды
r - радиус частиц в-ва
анализ уравнения:
- чем больше температура, тем больше коэффициент диффузии
- чем меньше вязкость среды, тем больше коэффициент диффузии
- чем меньше радиус частиц в-ва, тем больше коэффициент диффузии
радиус частиц в-ва увеличивается с ростом молярной массы
поэтому чем больше молярная масса в-ва, тем меньше коэффициент диффузии






