раствор – однородная система переменного состава из двух и более компонентов
раствор – однородная система, в которой любая часть объема р-ра имеет одинаковый хим.состав и физ.свойства
раствор – система из минимум двух компонентов - из растворителя и растворенного в-ва
если компоненты раствора находятся в разном агрегатном состоянии,
то за растворитель принимают то в-во, которое находится в одном агрегатном состоянии, что и раствор
ПР: сахар и вода, растворитель - вода,
если компоненты находятся в одном агрегатном состоянии, то за р-тель принимают то в-во, которого больше
ПР: воздух – газовый раствор, в котором растворитель – азот
сравнение растворов и смесей
растворы и смеси имеют переменный состав,
растворы и смеси разделяются физическими способами(перегонкой, выпариванием или перекристаллизацией..)
сравнение растворов и хим.соединений
растворы и хим.соединения однородны во всем объеме,
образование растворов и хим.соединений сопровождается тепловыми эффектами,
в растворах образуются соединения из молекул растворителя и растворенного в-ва
растворимость веществ, коэффициент растворимости
растворимость - способность в-в растворяться-переходить в раствор
показателем растворимости является коэффициент растворимости
коэффициент растворимости – max масса в-ва, которая может раствориться в 100 г растворителя!
по коэффициенту растворимости различают в-ва:
- растворимые >1,0 г в-ва в 100,0 мл растворителя ПР: KNO3 Na2SO4
- малорастворимые 0,1-1,0 г в-ва в 100,0 мл растворителя ПР: MgSO4 PbCl2
- нерастворимые <0,1 г в-ва в 100,0 мл растворителя ПР: CaCO3 BaSO4
состав растворов: доли и концентрации растворенного вещества
содержание в-ва в растворе характеризуется его долей в растворе и концентрацией раствора:
массовая доля w(%) есть массовая доля в-ва в 100 г! раствора
 |
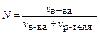 мольная доля N есть количество в-ва(моли) в общем количестве молей в-в раствора
мольная доля N есть количество в-ва(моли) в общем количестве молей в-в раствора
 молярная концентрация СМ (моль/л) есть количество в-ва(моли) в 1000 мл! раствора
молярная концентрация СМ (моль/л) есть количество в-ва(моли) в 1000 мл! раствора
моляльная концентрация Сm или моляльность(моль/кг) есть количество в-ва(моли) в 1000 г! растворителя
 |
молярная концентрация эквивалента вещества С1/Z или
нормальная концентрация или нормальность(моль/л) есть количество эквивалента в-ва(моли) в 1000 мл! р-ра
 |
если эквивалент вещества меньше реальной частицы вещества, то С1/Z > СМ
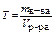 титр (г/мл)– отношение массы в-ва к объему раствора
титр (г/мл)– отношение массы в-ва к объему раствора
классификация растворов
различают растворы по агрегатному состоянию:
- газообразные ПР: воздух
- жидкие ПР: раствор Н2SO4 в воде(в растворе Н2SO4-Н2O-НSO4--SO42--Н+)
- твердые ПР: стекло, сплав Au+Ag
жидкие растворы образуют жидкость+газ, жидкость+жидкость, жидкость+твердое в-во
различают растворы по размерам частиц растворенного вещества:
- истинные, если размер частиц вещества <1 ммк
ПР: ионный раствор NaCl, молекулярный раствор глюкозы
- коллоидные, если размер частиц вещества 1-100 ммк
при таком размере частиц есть граница раздела фаз между частицей вещества-фазой и растворителем-средой
ПР: раствор белка
если размер частиц вещества >100 ммк, то образуются суспензии и эмульсии
различают растворы ненасыщенные-насыщенные-перенасыщенные
различают растворы разбавленные-концентрированные
различают растворы электролитов, растворы неэлектролитов






