Додано розчину NaOH (см3)
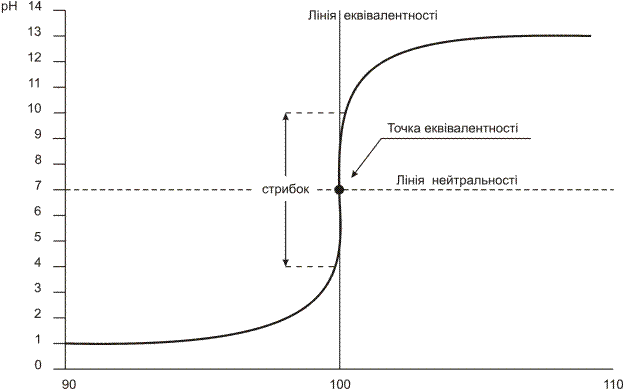
Таким чином, якщо проаналізувати зміну концентрацій реагуючих речовин поблизу точки еквівалентності в процесі титрування, то можна зробити наступний висновок. Після додавання 90% необхідної кількості реактиву в розчині залишається 10% (або 0,1 частина) взятої кількості досліджуваного компонента. Якщо зважити на умову про те, що об’єм розчину при титруванні не змінювався, то концентрація досліджуваного йона зменшилась в 10 разів. Якщо додати ще 9% робочого розчину (всього 99% від теоретично еквівалентної кількості), то невідтитрованим залишається 1% (або 0,01 частина) речовини. Тобто, концентрація речовини змінилась знову в 10 разів, але для цього потрібно було додати в 10 разів менше робочого розчину (9% замість 90%). Після додавання ще 0,9% (99,9% від теоретично еквівалентної кількості) концентрація речовини зменшилась знову в 10 разів і так далі. Таким чином, в міру наближення до точки еквівалентності для того, щоб викликати однакову зміну концентрації досліджуваного компонента, необхідно додавати кожного разу меншу кількість реактиву. Інакше кажучи, при рівномірному додаванні робочого розчину концентрація досліджуваного компонента змінюється стрибкоподібно.
Після точки еквівалентності умови рівноваги визначаються вже не залишком компонента, який визначають, а надлишком реактиву. Так, якщо додати 0,1% надлишку реактиву (100,1% від еквівалентної кількості), в розчині утворюється деяка надлишкова концентрація реактиву. Якщо додати 1% надлишку реактиву, концентрація його збільшиться в 10 разів, і у відповідності з законом діючих мас зменшиться концентрація досліджуваного компонента, і т.д. Таким чином, після точки еквівалентності продовжується зміна концентрацій в тому ж самому напрямку і крива титрування характеризується другою симетричною частиною.
Різка зміна концентрації гідроген-іонів від додавання останньої краплі робочого розчину називається стрибком титрування.
Необхідно відмітити, що криві титрування не мають безпосереднього відношення до вибору індикатора при титруванні. Точку еквівалентності визначають при умові еквівалентності, а також константи, яка характеризує властивості продукту реакції (розчинність, константу дисоціації кислоти і т.д.). Тому для вибору індикатора нема необхідності розраховувати всю криву титрування.
Криві титрування мають значення для загального уявлення про зміну концентрацій реагуючих речовин в процесі титрування та стрибкоподібний характер зміни їх поблизу точки еквівалентності. Головне в кривих титрування те, що за ними можна встановити можливість застосування об’ємного аналізу для визначення окремих речовин.
Точність вимірювання об’єму в даному методі аналізу становить ±0,1%. Тому, в об’ємному методі слід застосовувати тільки такі реакції і умови їх проведення, при яких в точці еквівалентності в стані рівноваги буде знаходитись не більше 0,1% компонентів, що не прореагували.
Розрахунки на основі цього положення дають можливість зробити наступні практичні висновки. При кислотно-основних методах аналізу можна використовувати тільки такі реакції, які відбуваються з утворенням таких продуктів, коли рН середовища при цьому знаходиться в межах від 4 до 10.
Так, при титруванні розчину HCl (с(1/1HCl)=0,1 моль/дм3) в кінці титрування може бути 0,1% від початкової концентрації йонів H+. Тобто с(H+) =0,1∙ 0,1 / 100 = 1 · 10–4 моль/дм3; рН=4,0.
По відношенню до індикаторів цей висновок можна сформулювати так: в кислотно-основних методах не застосовують індикатори з рТ <4 або>10. Це положення стосується всіх методів об’ємного аналізу. Так, при методі осадження, наприклад, можна знайти граничне значення ДР. Нехай титрують розчин з (с(1/1Х)=0,1 моль/дм3). В точці еквівалентності повинно залишитись не зв’язаними 0,1% йонів від початкової концентрації, тобто 0,1∙ 0,1 /100 = 1·10–4 моль/дм3. Тоді, ДР для АВ=(1·10–4)2=1·10–8. Тому в об’ємному аналізі можна використовувати тільки такі реакції осадження, при яких утворюються осади з ДР< 1·10–8. Або, при титруванні слабких кислот (основна реакція:
НА + ОН– ↔ Н2О + А–) треба, щоб сіль, яка утвориться, в точці еквівалентності гідролізувалась не більш як на 0,1%. Концентрація солі в точці еквівалентності ≈ 0,1 моль/дм3. Звідси, в точці еквівалентності [ОН–] в результаті гідролізу не повина перевищувати
0,1∙0,1% /100 =1·10–4 моль/дм3. Звідси рОН =4, а рН=10. З цього випливає, що не можна застосовувати в об’ємному аналізі таких кислотно-основних реакцій, при яких утворюються продукти, що створюють у розчині рН >10,0.
В іншій формі цю умову можна описати так. Для реакції гідролізу:
А– + Н2О ↔НА +ОН– можна написати константу гідролізу: К гідр. =
= [ОН–]·[HА]/[A–]; Якщо [ОН–] = 1·10–4 моль /дм3, [HА] =0,1=10–1,
К w =10–14, то [НА]=10–14 ∙10–1/ (10–4)2 =1· 10–7. Тобто [НА] не повина бути< 1·10–7 моль / дм 3.
У тому випадку, коли утворюються продукти реакції з кислим значенням рН середовища (титрування слабкої основи), то подібні розрахунки показують: не можна застосовувати кислотно-основні реакції, при яких продукти реакції створюють рН середовища ≤ 4,0.
Титрування слабкої кислоти. Як приклад розглянемо криву титрування розчину ацетатної кислоти лугом.
Умови титрування такі ж, як у випадку титрування сильної кислоти.
На початку титрування – це 100 см3 CH3COOH, с(1/1 CH3COOH) = 0,1 моль/ дм3; рН= ½рКк-ти – ½ lg Ск-ти= ½ 4,74 – ½ lg1 · 10–1 =
= 2,37 + 0,5 = 2,87.
Якщо додати кількість лугу, яка відповідатиме 9 см3 розчину з с(1/1CH3COOH)=0,1моль/дм3, 9% CH3COOH перетвориться в сіль CH3COONa і залишиться 91% невідтитрованої ацетатної кислоти. Тобто, утвориться буферний розчин, в якому співвідношення концентрацій солі та кислоти, а також рН становитиме: рН=рКк-ти + lg Ссолі/Скисл. = 4,74 + lg 1 – lg 10 = 3,8 (Ссолі /Скисл. = 9/91 =1/10.
Інші значення рН:
Після додавання 50 см3 розчину NaOH рН= 4,74 + lg 1/1 = 4,74;
– 91 см3 розчину NaOH рН= 4,74 + lg10 – lg1 =
=5,74
(Ссолі/Скисл. = 91/9 = 10/1;
– 99 см3 розчину NaOH рН= 4,74 + lg 100 = 6,74. Ссолі/Скисл.= 99/1 = 100/1;
– 99,9 см3 розчину NaOH рН= 4,74 + lg1000 =
= 7,74;
– 100,0 см3 розчину NaOH – утворюється сіль
CH3COONa,
рН= 7 + ½ рКкисл. +½ lg Ссолі = 7 +½ 4,74 +½ 10-1 = 9,37 – 0,5 =
= 8,87.
Якщо внесено розчину лугу 100,1 см3 , з’являється надлишок лугу 0,1см3. Концентрація його становитиме: 0,1∙0,1=100∙c(1/1NaOH); c(1/1NaOH) = 0,1∙ 0,1 / 100 = 1·10–4 моль/дм3; рОН = –lg [ОН–] = 4; рН= 10.
При внесенні розчину лугу об’ємом 101,0 см3 надлишок
розчину лугу становитиме 1 см3. Концентрація дорівнюватиме:
1∙0,1=100∙c(1/1NaOH); c(1/1NaOH)=1∙0,1/100=1·10–3 моль/дм3;
рОН = –lg [ОН–] = 3;рН = 11.
При загальному об’ємі розчину лугу110 см3 надлишок розчину лугу буде 10см3. Концентрація становитиме:
10∙0,1=100∙c(1/1NaOH); c(1/1NaOH) =10∙0,1/100 =1·10–2 моль/дм3;
рОН = –lg [ОН–] = 2; рН= 12.






