Задача 3.1. Під час циклу Карно газ, набравши від нагрівача 103 Дж тепла, виконав роботу 400 Дж. Знайти температуру нагрівача, якщо температура холодильника 0 °С.
Рішення. ККД ідеальної теплової машини
 або
або 
де 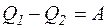 - корисне тепло, що перетворюється в роботу А.
- корисне тепло, що перетворюється в роботу А.
Числове значення ККД теплової машини
 або 40%.
або 40%.
Знаючи ККД теплової машини і температуру холодильника Т2, можна знайти температуру нагрівача
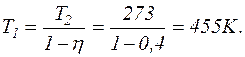
Відповідь: 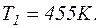
Задача 3.2. Визначити зміну ентропії при ізотермічному розширенні кисню масою 10 г від об'єму 25 л до об'єму 100 л.
Рішення. Зміну ентропії кисню при ізотермічному процесі можна обчислити за формулою

винесемо температуру за знак інтегралу, отримаємо

Кількість теплоти  , яку отримує кисень, знайдемо за першим законом термодинаміки:
, яку отримує кисень, знайдемо за першим законом термодинаміки: 
Для ізотермічного процесу  = 0, тобто
= 0, тобто  = А, а робота А для цього процесу визначається за формулою
= А, а робота А для цього процесу визначається за формулою

де М= 18×10 3 кг/моль - молярна маса кисню.
З урахуванням цієї формули, визначимо зміну ентропії
 .
.
Підставляючи в останню формулу числові значення величин, взятих в одиницях системи СІ, маємо

Відповідь:  = 6,4 Дж/К.
= 6,4 Дж/К.
Задача 3.3. Знайти зміну ентропії при охолодженні 2 г повітря від 40 до 0 °С: 1). при сталому об'ємі; 2). при сталому тиску.
Рішення. Зміну ентропії повітря наближено можна обчислити за формулою, що виражає зміну ентропії ідеального газу

при нескінченно малій зміні температури dT.
При нагріванні подається кількість теплоти
dQ=mcdT,
де т - маса повітря; с - його питома теплоємність.
Враховуючи, що V= const, VdP = RdT, звідки

а також із рівняння стану ідеального газу  знаходимо
знаходимо  . підставивши ці значення у рівняння для dQ, знаходимо
. підставивши ці значення у рівняння для dQ, знаходимо

Аналогічно знаходимо значення dQ для сталого тиску

У першому випадку сталим лишається об'єм, тому

Відношення Р2/Р1 знаходимо за рівнянням ізохоричного процесу

тоді

У другому випадку сталим лишається тиск, тому

Відношення V2/V1 знаходимо за рівнянням ізобаричного процесу
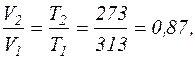
тоді

Відповідь: 1)  ; 2)
; 2) 
Задача 3.4. Обчислити, користуючись рівнянням Ван-дер-Ваальса, тиск 1,1 кг вуглекислого газу, що знаходиться в балоні місткістю 20 л при температурі 13 °С. Результат порівняти з тиском ідеального газу за тих самих умов.
Рішення. Рівняння Ван-дер-Ваальса має вигляд

звідки

де а= 0,364 м4×Н/моль2; b= 4,3×10-5 м3/моль.
Число молів вуглекислого газу дорівнює

Об'єм, що його займає один моль вуглекислого газу, дорівнює

Підставивши у формулу тиску числові значення величин, взятих в одиницях системи СІ, знаходимо
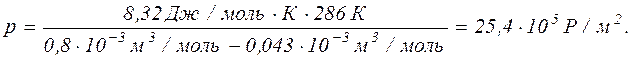
Тиск, що обчислюється за рівнянням Менделєєва-Клапейрона, дорівнює

Останній результат відрізняється від результату, одержаного при врахуванні поправок а та b на величину  = 4,3 • 105 Н/м 2, що дає відносну похибку
= 4,3 • 105 Н/м 2, що дає відносну похибку
 або 16,9 %.
або 16,9 %.






