Основні формули
1. Зв'язок між молярною Cm і питомою с теплоємністю газу:
Cm=cM
де М - молярна маса газу.
2. Молярні теплоємності при сталому об'ємі та сталому тиску відповідно дорівнюють


де i - число ступенів вільності молекули; R - універсальна газова стала.
3. Питомі теплоємності при сталому об'ємі і при сталому тиску відповідно дорівнюють:


4. Рівняння Майєра

5. Показник адіабати
 або
або 
6. Внутрішня енергія одного моля газу

7. Внутрішня енергія ідеального газу

де v - кількість речовини (кілограм-молей):
N - число молекулгазу;
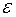 - середня кінетична енергія молекули.
- середня кінетична енергія молекули.
8. Змінавнутрішньої енергії

9. Робота, яку виконав газ під час розширення, в загальному випадку обчислюється за формулою

де V1 - початковий об'єм газу;
V 2 - його кінцевий об'єм.
Робота при:
· ізобарному процесі (р = const)

· при ізотермічому процесі (T=const)

· при адіабатичному процесі
 або
або 
де Т1 - початкова температура газу;
Т2 - його кінцева температура
10. Рівняння Пуассона (рівняння газового стану при адіабатичному процесі)

11. Зв'язок між початковим і кінцевим значеннями параметрів стану газу при адіабатичному процесі:
 ;
;  ;
; 
12.Перший закон термодинаміки в загальному вигляді
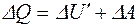
де  - кількість теплотипередана газу;
- кількість теплотипередана газу;
 - зміна його внутрішньої енергії;
- зміна його внутрішньої енергії;
 - робота, яка виконується системою проти зовнішніх сил.
- робота, яка виконується системою проти зовнішніх сил.
Перший закон термодинаміки при:
· ізобарному процесі

· при ізохорному процесі (А = 0)

при ізотермічному процесі ( )
)

при адіабатичному процесі (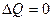 )
)