Концентрація розчину – відношення кількості розчиненої речовини до об’єму розчину  , відношення кількості речовини еквівалента до об’єму розчину
, відношення кількості речовини еквівалента до об’єму розчину 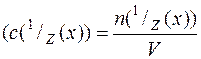 , відношення маси розчиненої речовини до об’єму розчину. В останньому випадку концентрація розчиненої речовини у розчині виражається його титром:
, відношення маси розчиненої речовини до об’єму розчину. В останньому випадку концентрація розчиненої речовини у розчині виражається його титром:
 г/см 3.
г/см 3.
Титр розчину показує, яка маса розчиненої речовини, виражена в грамах, міститься в 1 см 3 розчину.
В аналітичній хімії корисним є вираження титру робочого розчину (титранту) за речовиною, що визначається. Цей титр показує, якій масі (в грамах) речовини, що визначається, еквівалентний 1 см 3 розчину титранту певної молярної концентрації еквівалента.
Наприклад:  г/см 3.
г/см 3.
Оскільки в 1 см 3 розчину міститься дуже мало розчиненої речовини, то для того, щоб виразити концентрацію розчину через титр з великою точністю, значення титру слід подати з точністю до 0,00001 г/см 3 або 0,000001 г/см 3.
Основна одиниця вимірювання кількості речовини – моль відноситься до будь-яких видів частинок або певних груп частинок (атоми, молекули, йони, електрони, радикали тощо). Кількість речовини Х позначається символом n і записується як n(Х).
Молярна концентрація речовини Х у розчині позначається символом с – є відношення кількості речовини Х, що міститься в розчині, до об’єму цього розчину V:
 моль/дм 3.
моль/дм 3.
Молярна концентрація речовини у розчині змінюється із зміною температури.
Речовини взаємодіють між собою в еквівалентних кількостях. У кислотно-основних реакціях еквівалент кислоти чи основи – це така частинка цієї речовини, яка в даній кислотно-основній реакції звільняє один гідроген-іон або сполучається з ним, або іншим способом відповідна йому.
Еквівалент кислоти чи основи залежить від реакції, у якій бере участь ця речовина.
Наприклад: NaOH + H2SO4 = NaHSO4 + H2O.
У даній реакції одна молекула натрій гідроксиду взаємодіє з одним гідроген-іоном сульфатної кислоти або один моль натрій гідроксиду взаємодіє з одним молем сульфатної кислоти: n (NaOH) = n (H2SO4).
Число, яке показує, яка частка реальної частинки речовини Х еквівалентна одному гідроген-іону в даній кислотно-основній реакції, називається фактором еквівалентності речовини Х. Фактор еквівалентності є величиною безрозмірною і позначається fекв (Х), а форма запису еквівалента речовини Х буде такою: fекв (Х) Х. Величина fекв (Х) Х називається еквівалентом речовини Х. У даній реакції фактор еквівалентності сульфатної кислоти дорівнює 1: fекв (H2SO4)=1, а форма запису еквівалента цієї речовини у цій реакції буде:
fекв (H2SO4)H2SO4 = H2SO4.
Якщо натрій гідроксид взаємодіє з сульфатною кислотою за реакцією:
2NaOH + H2SO4 = Na2SO4 + 2H2O,
то на кожну частинку сульфатної кислоти припадає дві частинки натрій гідроксиду або на 1 моль сульфатної кислоти припадає 2 моль натрій гідроксиду, отже, з 1 моль NaOH взаємодіє ½ моль H2SO4.
У даній реакції фактор еквівалентності H2SO4 дорівнює ½: fекв (H2SO4)=½, а еквівалент сульфатної кислоти у цій реакції – fекв (H2SO4)H2SO4=½H2SO4.
n (NaOH) = n (½H2SO4).
Отже, фактор еквівалентності речовини Х розраховують на основі стехіометричних коефіцієнтів у рівнянні реакції. Тому при визначенні еквівалента речовини обов’язково слід вказати в якій реакції бере участь ця речовина.
Фактор еквівалентності речовини може бути рівним одиниці або меншим одиниці.
Молярна маса речовини еквівалента – це маса 1 моль речовини еквівалента fекв (Х) Х, що дорівнює добутку фактора еквівалентності на молярну масу речовини Х. Молярна маса речовини еквівалента fекв (Х) Х записується М (fекв (Х) Х) = fекв (Х)· М (Х).
Наприклад: у реакції 2NaOH + H2SO4 = Na2SO4 + 2H2O молярна маса еквівалента сульфатної кислоти визначається:
М (fекв (H2SO4)H2SO4) = fекв (H2SO4)· М (H2SO4)
М (½H2SO4) = ½ М (H2SO4);
М (½H2SO4) = ½·98 г/моль = 49 г/моль.
Одиницею кількості речовини еквівалента є моль: n (fекв (Х) Х).
В реакціях обміну, що супроводжуються утворенням осаду, молярні маси еквівалентів реагуючих речовин теж визначаються за рівняннями реакцій.
Наприклад: ZnCl2 + 2AgNO3 = 2AgCl$ + Zn(NO3)2.
У цій реакції 1 моль хлорид-іонів еквівалентний ½ моль речовини цинк хлориду. Але 1 моль хлорид-іонів еквівалентний 1 моль гідроген-іонів.
Таким чином, ½ моль ZnCl2 еквівалентний 1 моль гідроген-іонів.
Фактор еквівалентності fекв (ZnCl2)=½; фактор еквівалентності fекв (AgNO3)=1.
М (fекв (ZnCl2)ZnCl2) = fекв (ZnCl2)· М (ZnCl2);
M (½ZnCl2) = ½ M (ZnCl2);
M (½ZnCl2) = ½·65,4 г/моль = 32,7 г/моль.
Аналогічно розраховуються молярні маси еквівалентів інших учасників реакції.
Розрахунки еквівалентів речовин в окисно-відновних реакціях.
Еквівалент речовини, що бере участь в окисно-відновній реакції, визначається як та її частинка, яка може приєднати один електрон або звільнити його чи іншим способом може бути еквівалентна одному електрону.
Наприклад, окиснення ферум(ІІ) сульфату калій перманганатом у середовищі сульфатної кислоти відбувається за рівнянням:
 Фактор еквівалентності відновника (Fe2+) чи окисника (
Фактор еквівалентності відновника (Fe2+) чи окисника (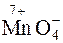 ) визначається на основі зміни ступеня окиснення атома елемента. Зміна ступеня окиснення (Δ Z) відновника (Fe2+"Fe3+) становить 1, а окисника (
) визначається на основі зміни ступеня окиснення атома елемента. Зміна ступеня окиснення (Δ Z) відновника (Fe2+"Fe3+) становить 1, а окисника ( "Mn2+) дорівнює 5, тоді фактор еквівалентності FeSO4 дорівнює 1 (fекв (FeSO4)=1), а КMnO4–
"Mn2+) дорівнює 5, тоді фактор еквівалентності FeSO4 дорівнює 1 (fекв (FeSO4)=1), а КMnO4– 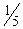 . (fекв (КMnO4)=
. (fекв (КMnO4)= 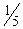 ). Еквівалент КМnO4 у цій окисно-відновній реакції виражається:
). Еквівалент КМnO4 у цій окисно-відновній реакції виражається:
fекв (КMnO4)КMnO4 = 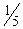 КMnO4.
КMnO4.
Молярна маса речовини еквівалента має величину:
М (fекв (КMnO4)КMnO4) = fекв (КMnO4)· М (КMnO4)
М (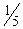 КMnO4) =
КMnO4) = 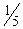 М (КMnO4);
М (КMnO4);
М (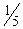 КMnO4) =
КMnO4) = 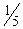 ·158 г/моль = 31,6 г/моль.
·158 г/моль = 31,6 г/моль.
Кількість речовини еквівалента n (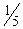 КMnO4) = 1 моль.
КMnO4) = 1 моль.
Розрахунки еквівалентів речовин у реакціях комплексоутворення.
Еквівалент речовини у реакціях комплексоутворення, як і в інших випадках, визначають за реакцією комплексоутворення.
Наприклад: Al2(SO4)3 + 12NaOH = 2Na3[Al(OH)6] + 3Na2SO4
1 моль 12 моль
або 1 молекула 12 молекул
1 молекула 12 ОН–-іонів
 моль 1 моль ОН–-іонів
моль 1 моль ОН–-іонів
У цій реакції 1 моль гідроксид-іонів еквівалентний  моль речовини алюміній сульфату. Але один гідроксид-іон еквівалентний одному гідроген-іону. Отже,
моль речовини алюміній сульфату. Але один гідроксид-іон еквівалентний одному гідроген-іону. Отже,  моль алюміній сульфату еквівалентна 1 моль гідроген-іонів.
моль алюміній сульфату еквівалентна 1 моль гідроген-іонів.
Фактор еквівалентності fекв (Al2(SO4)3)=  . Еквівалент Al2(SO4)3 визначається так: fекв (Al2(SO4)3)Al2(SO4)3 =
. Еквівалент Al2(SO4)3 визначається так: fекв (Al2(SO4)3)Al2(SO4)3 =  Al2(SO4)3.
Al2(SO4)3.
Молярна маса речовини еквівалента дорівнює:
М (fекв (Al2(SO4)3)Al2(SO4)3) = fекв (Al2(SO4)3)· М (Al2(SO4)3);
М (1/12Al2(SO4)3) =  ·437,96 г/моль;
·437,96 г/моль;
М(1/12Al2(SO4)3) = 36,5 г/моль
для наведеної вище реакції комплексоутворення.
Молярна концентрація речовини еквівалента у розчині є відношення кількості речовини еквівалента n (fекв (Х) Х) у розчині до об’єму цього розчину речовини.
Молярна концентрація речовини еквівалента виражається:
с (fекв (Х) Х) =  моль/дм 3;
моль/дм 3;
Наприклад: с (½Н2SO4) = 0,5 моль/дм 3.
Якщо 1 моль речовини еквівалента міститься в 1 дм 3 розчину, то такий розчин можна назвати нормальним.
Концентрацію розчинів не слід плутати зі складом розчинів. Склад розчину не відображає концентрацію розчиненої речовини, а є співвідношення між компонентами системи, кількості яких виміряні в однакових одиницях. Таким чином, склад розчину є безрозмірною величиною.
Розрізняють такі способи вираження складу розчинів:
1. Масова частка – відношення маси розчиненої речовини до маси розчину:
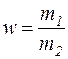 ;
;
2. Об’ємна частка – відношення об’єму розчиненої речовини до об’єму розчину:
 ;
;
3. Мольна частка – відношення числа молів розчиненої речовини до суми молів розчиненої речовини і розчинника:
 ;
;
4. Мольне відношення – відношення числа молів компонента на один моль розчинника:
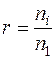 ;
;
5. Мольна частка – відношення числа молів розчиненої речовини до 1000 г розчинника:
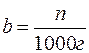 .
.
Якщо розчинник – вода, то 1000 г – це 1000/18 = 55,56 моль води.
Тоді 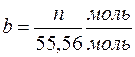 , тобто це є відношення кількості молів розчиненої речовини, що припадає на 1 моль розчинника.
, тобто це є відношення кількості молів розчиненої речовини, що припадає на 1 моль розчинника.






