Реакції нейтралізації – взаємодія кислот з основами з утворенням солей і води.
Реакції нейтралізації бувають незворотні і зворотні.
Оскільки солі у водних розчинах знаходяться у вигляді йонів, що перебувають у русі і контактують з молекулами і йонами води, то для випадків зворотних реакцій нейтралізації взаємодія йонів солі з йонами води називається гідролізом солей.
Реакції нейтралізації між сильними кислотами і сильними основами є незворотними і можуть бути представлені одним рівнянням реакції:
Н+ + ОН– = Н2О.
Наприклад:
NaOH + HCl = NaCl + H2O;
Na+ + ОН– + Н+ + Cl– = Na+ + Cl– + H2O;
Н+ + ОН– = H2O.
Взаємодії води з йонами Na+ і Cl– з утворенням вихідних речовин відбуватися не може. Реакції завжди йдуть у бік утворення малодисоційованої речовини.
Реакції нейтралізації між сильною кислотою і слабкою основою є зворотними:
HCl + NH4OH D NH4Cl + H2O;
H+ + Cl– + NH4OH D NH4+ + Cl– + H2O;
H+ + NH4OH D NH4+ + H2O.
У даному випадку відбувається гідроліз солі NH4Cl за катіоном  .
.
Реакції нейтралізації між сильною основою і слабкою кислотою теж є зворотними:
NaOH + CH3COOH D CH3COONa + H2O;
Na+ + OH– + CH3COOH D CH3COO– + Na+ + H2O;
OH– + CH3COOH D CH3COO– + H2O.
У цьому випадку відбувається гідроліз солі СН3СООNa за аніоном СН3СОО–.
Зворотними є і реакції нейтралізації між слабкою кислотою і слабкою основою:
CH3COOH + NH4OH D CH3COONH4+H2O;
CH3COOH + NH4OH D CH3COO– + NH4+ + H2O.
Відбувається гідроліз солі CH3COONH4 і за катіоном NH4+, і за аніоном CH3COO–.
До реакцій гідролізу солей можна застосувати закон діючих мас.
Для реакції: CH3COO– + H2O D CH3COOH + OH– константа рівноваги
 .
.
Концентрація води с (H2O) практично постійна.
Kр ∙ с (H2O) = Kг (константа гідролізу).
 .
.
Дисоціація СН3СООН:
СН3СООН D СН3СОО– + Н+.
Константа дисоціації кислоти  .
.
Підставимо значення 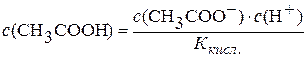 у рівняння константи гідролізу:
у рівняння константи гідролізу:


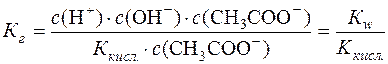 .
.
Таким чином, константа гідролізу гідролітично лужної солі дорівнює відношенню йонного добутку води до константи дисоціації слабкої кислоти, утвореної в результаті гідролізу аніона солі.
Виходячи з наведеного:
 .
.
Оскільки при гідролізі СН3СОО– утворюється рівна кількість молекул СН3СООН і йонів OH–, тобто с (СН3СООН) = с (OH–), рівняння константи гідролізу можна переписати так:
 ,
,
де с – аналітична концентрація солі.
З рівняння йонного добутку води Kw = c (H+)∙ c (OH–) можна записати:
 .
.
Підставляючи цей вираз у рівняння  маємо:
маємо:
 ;
;  ;
;


 .
.
Логарифмуючи цей вираз і змінюючи знаки на протилежні, отримаємо рівняння для розрахунку p H розчину гідролітично лужної солі:
 .
.
Враховуючи, що Kw =1∙10-14 і –lg Kкисл. =рК, отримуємо:
 ; с – аналітична концентрація солі (моль/дм 3).
; с – аналітична концентрація солі (моль/дм 3).
Ступінь гідролізу h солі є відношення кількості солі, яка вступила в реакцію гідролізу до всієї кількості розчиненої солі.
У момент рівноваги с (ОН–)= с (СН3СООН)= с · h, а с (СН3СОО–)= с – ch – загальній концентрації солі, так як солі даного типу гідролізуються відносно мало, тобто с» с ∙ h.
Підставляючи ці концентрації у формулу  , отримуємо:
, отримуємо:
 ;
;  ;
;  .
.
Враховуючи, що  ,
,  .
.
Для реакції  + H2O D NH4OH + H+ константа рівноваги
+ H2O D NH4OH + H+ константа рівноваги
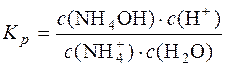 ;
;
Kр · с (Н2О) = Kг;
Kг =  .
.
Дисоціація NH4OH:
NH4OH D  + ОН–.
+ ОН–.
Константа дисоціації NH4OH:
 .
.
Звідси:  .
.
 Підставимо значення с(NH4OH) у рівняння константи гідролізу:
Підставимо значення с(NH4OH) у рівняння константи гідролізу:

 ;
;  .
.
Отже, константа гідролізу гідролітично кислої солі є відношення йонного добутку води до константи дисоціації слабкої основи, яка утворюється в результаті гідролізу катіона солі.
 .
.
У стані рівноваги с (NH4OH) = с (H+). Тоді можна записати:
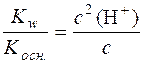 ,
,
де с – аналітична концентрація солі.
З цієї формули с 2(Н+)· Kосн. = Kw · ссолі; с 2(Н+) =  ;
;
 .
.
Логарифмуючи останній вираз і змінюючи знаки на протилежні, отримаємо:
–lg c (H+) = –½lg Kw – ½lg cсолі + ½lg Kосн.
Kw = 1·10–14, –lg Kосн. = рKосн.
p H = 7 – ½ рKосн. – ½lg cсолі
У момент рівноваги с (NH4OH) = с (H+) = с · h
Тоді рівняння константи гідролізу можна записати:
 ; Kг = h 2· c;
; Kг = h 2· c; 
 ;
;  ;
;  .
.
Для реакції гідролізу солі, що гідролізується і за катіоном, і за аніоном,
 + СН3СОО– + Н2О D NH4OH + СН3СООН;
+ СН3СОО– + Н2О D NH4OH + СН3СООН;
константа рівноваги:

Концентрація води с (Н2О) є постійною. Тоді можна записати:

Дисоціація NH4OH: NH4OH D  + ОН–. Константа дисоціації основи:
+ ОН–. Константа дисоціації основи:
 .
.
Звідси:
 .
.
Дисоціація СН3СООН: СН3СООН D СН3СОО– + Н+.
Константа дисоціації кислоти:  .
.
Звідси: 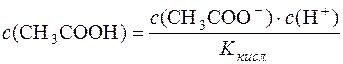 .
.
Підставимо значення с (NH4OH) і с (СН3СООН) у момент рівноваги у формулу константи гідролізу:




 ;
;
 .
.
У момент рівноваги с (NH4OH) = с (СН3СООН) = с · h.
с ( ) = с – с · h; с (СН3СОО–) = с – с · h.
) = с – с · h; с (СН3СОО–) = с – с · h.
 ;
;  ;
; 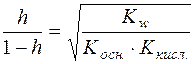 ;
;
 .
.
Отже, гідроліз солей – це взаємодія йонів солі з йонами води, що супроводжується порушенням рівноваги електролітичної дисоціації води і утворенням малодисоційованих продуктів, що призводить до накопичення йонів Н+ або ОН–, тобто до виникнення кислої чи лужної реакції розчину.
Значення гідролізу в якісному аналізі
Реакції гідролізу широко розповсюдженні при виконанні якісного аналізу. Вони використовуються як характерні реакції виявлення деяких катіонів і аніонів. Так, наприклад, розчинна сіль Bi(NO3)3, зазнаючи гідролізу, утворює важкорозчинні основні солі Bi(OH)(NO3)2, Bi(OH)2NO3. Реакцією гідролізу відкривають катіони Алюмінію, аніони SiO32-, CH3COO- та інші:
2Na2SiO3 + 3HOH + 4NH4Cl D H2Si2O5 + 4NaCl + 4NH4OH
У даному випадку має місце гідроліз силікат-аніона, в результаті чого утворюється метакремнієва кислота:
SiO32– + 2HOH D H2SiO3 + 2OH–
Гідролітичне розщеплення силікатів супроводжується утворенням колоїдів поліметакремнієвих кислот, зокрема діметакремнієвої кислоти H2Si2O5. Гідроліз натрій силікату гальмується тим, що середовище накопичує гідроксид-іони. Для підсилення гідролізу додають у розчин кислоту та амоній хлорид для зв’язування гідроксид-іонів:
2OH– + 2H+ D 2H2O
2NH4+ + 2OH- D 2NH4OH
При нагріванні гідроліз силікатів покращується. При цьому відбувається часткова дегідратація метакремнієвої кислоти:
2H2SiO3 → H2Si2O5 + H2O,
а амоній гідроксид при нагріванні (точніше NH3∙H2O) розщеплюється з видаленням з розчину амоніаку, що призводить до посилення процесу гідролізу силікату.
Реакції гідролізу використовуються і для розділення йонів. Так, для розділення йонів Al3+ та Cr3+ до досліджуваного розчину додають надлишок лугу:
Al3+ + 6OH– D [Al(OH)6]3–
Cr3+ + 6OH– D [Cr(OH)6]3–; [Cr(OH)6]3– D CrO33– + 3H2O;
При кип’ятінні такої суміші [Cr(OH)6]3- гідролізується і в осад випадає Cr(OH)3:
CrO33– + 3HOН → Cr(OH)3 + 3OH−
Реакції гідролізу використовуються і для регулювання рН досліджуваного середовища. Наприклад, для підвищення рН середовища до розчину додають сіль, яка гідролізується за аніоном, в результаті чого підвищується концентрація у розчині гідроксид-іонів:
CO32– + HOH D HCO3− + OH−,
а для зниження рН середовища до нього додають сіль, яка гідролізується за катіоном:
2NH4+ + HOH D NH4OH + H+
Інколи буває необхідно пригнічувати гідроліз солей, коли він заважає проведенню аналізу. Якщо сіль гідролізується за аніоном, то для пригнічення її гідролізу у розчин необхідно ввести луг і тоді, згідно із законом діючих мас, рівновага реакції гідролізу солі буде зміщена ліворуч, а коли сіль гідролізується за катіоном, то для пригнічення її гідролізу слід до розчину додати кислоту. Наприклад:
Fe2+ + 2HOH D Fe(OH)2 + 2H+
Для посилення гідролізу солей треба зв’язувати чи йони гідроксонію, чи гідроксид-іони в залежності від того, за яким йоном гідролізується сіль. Для зв’язування йонів гідроксонію чи гідроген-іонів можна застосувати не тільки розчини кислот чи основ, а також розчини солей сильних основ і слабких кислот, наприклад: Na2CO3, Na2HPO4, CH3COONa і ін. Ці солі зв’язують йони гідроксонію з утворенням гідрогенаніонів HCO3-, H2PO4- або нейтральних молекул слабких кислот:
CO32– + H+ → HCO3–
HCO3– + H+ → H2CO3 → H2O + CO2
Гідроксид-іони можна зв’язувати в комплексні йони, діючи солями слабких основ і сильних кислот, наприклад:
Al3+ + OH− → [Al(OH)]2+
[Al(OH)]2+ + OH– → [Al(OH)2]+
Ступінь гідролізу солей збільшується при нагріванні, так як при цьому збільшується швидкість прямої реакції гідролізу, а крім того, збільшується і константа дисоціації води. Ступінь гідролізу залежить від концентрації солі в розчині: чим менша концентрація солі, тим більший ступінь її гідролізу.






