Количество вещества, выделившееся на катоде и аноде, зависит от числа электронов, участвующих в окислительно-восстановительном процессе, т. е. от количества электричества, прошедшего через раствор или расплав электролита. Эта зависимость выражается законом Фарадея:
массы веществ, выделившиеся на электродах, пропорциональны количеству прошедшего электричества через раствор или расплав электролита и химическому эквиваленту. При прохождении через раствор или расплав электролита 96500 Кл на электродах выделяется один моль эквивалентов вещества (постоянная Фарадея).
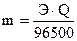 ,
,
где m – масса вещества, выделившегося на электроде, г;
Q – количество электричества, Кл;
Э – эквивалентная масса выделившегося вещества, г/моль-экв.
Так как Q = I·t,
где I – ток, А, t – время, с,
то уравнение закона Фарадея можно записать в следующем виде:
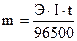 .
.
Эквивалентная масса (Э) равна молярной массе вещества, деленной на количество принятых или отданных электронов.
Примеры решения типовых задач
Задача 1. Определить массу выделившейся меди при пропускании тока 10 А через раствор сульфата меди в течение 2 часов.
CuSO4 ⇄ Cu2+ + SO 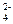 .
.
На катоде выделяется медь при восстановлении ионов Cu2+:
Cu2+ + 2 ē = Cu.
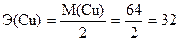 г/моль-экв,
г/моль-экв,
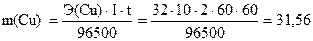 г.
г.
Задача 2. Сколько времени нужно пропускать ток силой 5 А, чтобы из раствора серной кислоты выделить 50 л водорода, измеренных при нормальных условиях?
H2SO4 ⇄ 2H+ + SO 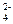 .
.
Количество моль-эквивалентов (ν)выделенного водорода ν = m:Э = V:Vэ.
Объемный эквивалент водорода VM:2 = 22,4:2 = 11,2 л/моль,
так как для образования одной молекулы водорода два иона водорода принимают два электрона: 2H+ + 2 ē = H2↑.
Из закона Фарадея следует
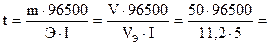 86161 с = 23,9 ч.
86161 с = 23,9 ч.
Содержание дисциплины «Общая химия»
Реакции ионного обмена. Произведение растворимости. Гидролиз. Амфотерность. Окислительно-восстановительные реакции. Степень окисления и валентность. Общие принципы составления уравнений окислительно-восстановительных реакций. Электрохимические процессы. Гальванические элементы и аккумуляторы. Стандартные электродные потенциалы. Ряд напряжений. Направление окислительно-восстановительных реакций и ЭДС. Электролиз. Закон Фарадея.
Библиографический список
- Коровин Н.В. Курс общей химии. – М.: Высшая школа, 1990. С. 168-172; 185-216.
- Глинка Н.Л. Общая химия. – Л.: Химия, 1988. С. 245-265.
- Глинка Н.Л. Задачи и упражнения по общей химии. - Л.: Химия, 1985, с. 141-148, 151-164, 168-176, 179-187.
Теоретические вопросы, упражнения, задачи для подготовки к контрольной работе. Индивидуальные домашние задания
I.Теоретические вопросы
- Какие реакции называются ионно-обменными? Чем они отличаются от окислительно-восстановительных реакций?
- Условия одностороннего протекания ионно-обменных реакций. Приведите примеры таких реакций.
- Амфотерные гидроксиды. Приведите примеры амфотерных гидроксидов и их реакций с растворами кислот и щелочей.
- Что является мерой растворимости малорастворимых веществ?
- Что такое произведение растворимости? Что оно характеризует?
- Как, зная произведение растворимости соли, определить концентрацию насыщенного раствора малорастворимой соли?
- Что такое гидролиз? Какие соли подвергаются гидролизу?
- Что является мерой способности соли подвергаться гидролизу?
- Константа гидролиза. От каких факторов она зависит? Каким образом можно уменьшить степень гидролиза?
- Что такое степень окисления? Как определить степень окисления атома элемента в сложных веществах?
- Какие реакции называют окислительно-восстановительными? Приведите пример такой реакции.
- Какие вещества называют окислителями и восстановителями? Основные окислители и восстановители. Приведите примеры.
- Что происходит с окислителями в ходе окислительно-восстановительной реакции? Как изменяется степень окисления атома элемента, входящего в состав окислителя?
- Что происходит с восстановителем в ходе окислительно-восстановительной реакции? Как изменяется степень окисления атома элемента, входящего в состав восстановителя?
- Порядок восстановления катионов на катоде и анионов на аноде при электролизе с инертными электродами.
- Как определить эквивалентную массу вещества в окислительно-восстановительной реакции?
II.Упражнения
a) Какие из приведенных пар веществ реагируют между собой в растворе практически до конца? Составьте уравнения реакций в молекулярной, ионно-молекулярной и краткой ионной формах.
17. BaCl2 + Na2SO4; KNO3 + NaOH;
AlCl3 + KOH; HCl + Na2CO3.
18. K2S + H2SO4; NaNO3 + CaCl2;
Na2CO3 + CaCl2; CuSO4 + NaCl.
19. CaCl2 + AgNO3; NaCl + K2SO4; Zn(OH)2 + KOH; FeCl3 + NaOH.
20. K2CO3 + HCl; Ca(NO3)2 + KCl; ZnCl2 + NaOH; Na2SO4 + KNO3.
21. AlCl3 +Na3PO4; K2SO4 + NaNO3; ZnSO4 + Na2S; Cu(NO3)2 + CaCl2.
22. FeCl2 + KOH; Ca(NO3)2 + KCl; Al(OH)3 +KOH; ZnSO4 + Na2S.
23. Na3PO4 + CaCl2; FeS + HCl; Cu(OH)2 + NaOH; KCl + Na2SO4.
б) Какие из приведенных солей подвергаются гидролизу? Для них напишите уравнения реакций гидролиза по первой ступени в молекулярной, ионно-молекулярной и краткой ионной формах.
24. Cu(NO3)2, Ca(NO3)2, K2S, Na2SO4.
25. CaS, Na3PO4, KNO3, NaCl.
26. Zn(NO3)2, K2SO4, Ca(NO3)2, K2CO3.
27. AlCl3, KNO3, Na2SO3, Na2SO4.
28. KCl, Na2S, CuCl2, Ca(NO3)2.
29. CaCl2, Al2S3, NaNO3, CuSO4.
30. NaCl, Na2S, AlCl3, NH4CN.
в) Каким молекулярным и ионно-молекулярным уравнениям соответствуют следующие краткие ионные уравнения?
31. Al3+ + HOH ⇄ AlOH2+ + H+; Al3+ + 4 OH- = [Al(OH)4]-.
32. CO 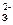 + 2H+ = H2O + CO2; PO
+ 2H+ = H2O + CO2; PO 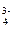 + HOH ⇄ HPO
+ HOH ⇄ HPO 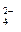 + OH-.
+ OH-.
33. Cu2+ + 2OH- = Cu(OH)2; S2- + HOH ⇄ HS- + OH-.
34. Zn2+ + HOH ⇄ ZnOH+ + H+; Ba2+ + SO 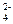 = BaSO4.
= BaSO4.
35. Be(OH)2 + 2OH- = [Be(OH)4]2-; SO 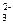 + HOH ⇄ HSO
+ HOH ⇄ HSO  + OH-.
+ OH-.
36. Ag+ + Cl- = AgCl; Al3+ + 6OH- = [Al(OH)6]3-.
37. Cu2+ + S2- = CuS; Zn2= + 4OH- = [Zn(OH)4]2-.
г) Составьте электронный баланс и на его основе расставьте коэффициенты в следующих уравнениях реакций:
38. NaBr + NaBrO3 + H2SO4 → Br2 + Na2SO4 + H2O;
Zn + HNO3 → Zn(NO3)2 + N2O+ H2O.
39. KNO2 + KMnO4 + H2SO4 → KNO3+ MnSO4 + + K2SO4 + H2O;
P + HNO3 + H2O → H3PO4 + NO.
40. Na2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + + Na2SO4 + K2SO4 + H2O;
Br2 + KOH → KBr + KBrO3 + H2O.
41. KJ + KMnO4 + H2SO4 → J2 + MnSO4 + K2SO4 + + H2O;
H2S + HClO → HCl + H2SO4.
42. Zn + HNO3 → Zn(NO3)2 + NH4 NO3 + H2O;
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + + H2O.
43. Ag + HNO3 → AgNO3 + NO + H2O;
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + + K2SO4 ++ H2O.
44. FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O;
Cu + H2SO4 → CuSO4 + SO2 + H2O.
45. S + HNO3 → H2SO4 + NO2 + H2O;
MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O.
46. Fe(OH)2 + O2 + H2O → Fe(OH)3;
MnSO4 + KMnO4 + H2O → MnO2 + K2SO4 + + H2SO4.
47. Zn + H2SO4 → ZnSO4 + H2S + H2O;
MnO2 + KClO3 + K2CO3→ K2MnO4 + KCl + CO2.
д) Составьте схемы электролиза с инертными электродами:
48. Раствора хлорида натрия и расплава гидроксида калия;
49. Раствора сульфата меди (II) и расплава хлорида натрия;
50. Раствора сульфата натрия и раствора хлорида натрия;
51. Раствора хлорида меди (II) и раствора хлорида кальция;
52. Раствора хлорида калия и расплава гидроксида калия;
53. Раствора гидроксида натрия и расплава гидроксида натрия;
54. Раствора сульфата натрия и раствора хлорида меди (II);
55. Раствора серной кислоты и раствора гидроксида натрия;
56. Раствора хлорида магния и расплава гидроксида калия.
57. Составьте схему электролиза раствора сульфата меди (II) с медными электродами.






