Эквивалентная масса (Э) - масса одного моль-эквивалента - окислителя или восстановителя определяется делением молярной массы окислителя или восстановителя на число принятых или отданных электронов соответственно. Эквивалентная масса перманганата калия будет различной в зависимости от реакции среды: M(KMnO4) = 158 г/моль,
в кислой среде:
 г/моль-экв;
г/моль-экв;
в нейтральной среде:
 г/моль-экв;
г/моль-экв;
в сильнощелочной среде:
 г/моль-экв.
г/моль-экв.
Пример решения типовой задачи
Задача. Сколько литров сероводорода, измеренных при нормальных условиях, можно окислить 500 мл 0,2 н раствора дихромата калия в кислой среде?
Необходимо написать уравнение реакции и, составив электронный баланс, расставить коэффициенты в уравнении реакции:
3H2S + K2Cr2O7 + 4H2SO4 = 3S +Cr2(SO4)3 + K2SO4 + 7H2O;



 - 2ē =
- 2ē =  6 3
6 3
2  + 6ē = 2
+ 6ē = 2  2 1
2 1
Чтобы коэффициенты в уравнении реакции были наименьшими, необходимо коэффициенты, стоящие перед восстановителем и окислителем, уменьшить в два раза. Однако соотношение между ними должно оставаться прежним.
Определяем массу дихромата калия, содержащуюся в 500 мл 0,2 н раствора, исходя из определения нормальности: 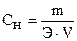 , отсюда m =
, отсюда m =  ·Э·V.
·Э·V.
Необходимая для этого расчета эквивалентная масса определяется, как указывалось ранее, делением молярной массы дихромата калия, равной 294 г/моль, на число принятых этой молекулой электронов:
 г/моль-экв.
г/моль-экв.
Масса K2Cr2O7 будет равна
m(K2Cr2O7) = Cн·Э (K2Cr2O7)·V = 0,2·49·0,5 = 4,9 г.
Из уравнения реакции следует:
3 моля H2S реагируют с 1 моль K2Cr2O7,
3 · 22,4 л H2S реагируют с 294 г K2Cr2O7,
V(H2S) л H2S реагирует с 4,9 г K2Cr2O7.
 л.
л.
Ответ: можно окислить 1,12 л сероводорода.






