Гидролиз – это ионно-обменная реакция между водой и растворенным в ней веществом. Здесь будем рассматривать гидролиз солей.
Каждую соль можно представить как продукт нейтрализации кислоты основанием, т. е. каждая соль образована какой-то кислотой и каким-то основанием.
Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой; слабым основанием и сильной кислотой; слабой кислотой и слабым основанием.
Гидролиз – это обратимый равновесный процесс. В реакциях гидролиза знак равенства заменяют знаком обратимости - двумя противоположно направленными стрелками.
Соли, образованные многоосновными кислотами или многоатомными основаниями гидролизуются ступенчато, образуя на первой ступени кислые или основные соли. Вторая ступень идет в гораздо меньшей степени, чем первая.
1. Гидролиз соли, образованной сильным основанием и слабой кислотой (I ступень):
Na2CO3 + HOH ⇄ NaHCO3 + NaOH;
2Na+ + C 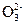 + HOH ⇄ HCO3- + 2Na+ + OH-;
+ HOH ⇄ HCO3- + 2Na+ + OH-;
C 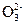 + HOH ⇄ HCO3- + OH-.
+ HOH ⇄ HCO3- + OH-.
В ходе реакции образуется кислая соль. Краткая ионная форма записи показывает, что в реакции принимает участие анион, поэтому говорят, что в этом случае происходит гидролиз по аниону. В результате гидролиза образуется избыток гидроксид-ионов, поэтому раствор карбоната натрия имеет щелочную реакцию со значением рН > 7.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой (I ступень):
ZnCL2 + HOH ⇄ ZnOHCl + HCl;
Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + 2Cl- + H+;
Zn2+ + HOH ⇄ ZnOH+.
В этом случае происходит гидролиз по катиону. В результате гидролиза образуется избыток ионов водорода,
поэтому раствор соли имеет кислую реакцию со значением рН < 7.
3. Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4 + HOH ⇄ CH3COOH + NH4OH;
CH3COO- + NH4+ + HOH ⇄ CH3COOH + NH4OH.
В этом случае гидролиз происходит как по аниону, так и по катиону. Реакция раствора практически нейтральна и значение рН близко к 7.
Количественной характеристикой протекания реакции гидролиза является константа равновесия (Кp). Для реакции гидролиза карбоната натрия по первой ступени можно написать выражение константы равновесия
 .
.
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая K·[H2O] =  ., получим выражение для константы гидролиза:
., получим выражение для константы гидролиза: 
Степень гидролиза, т. е отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ.
В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается.
Для подавления гидролиза нужно использовать концентрированные растворы при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь.
Соли, образованные слабой многоосновной кислотой и слабым многоатомным основанием, гидролизуются необратимо, например, Al2S3, Cr2S3:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑.
Эти и подобные им соли не существуют в растворах.






