Пример 1. Электролиз расплава хлорида натрия на инертных электродах.
NaCl ⇄ Na+ + Cl-.
Катод (-): Na+ + 1ē = Na.
Анод (+): 2Cl- - 2ē = Cl2↑.
Пример 2. Электролиз расплава гидроксида натрия на инертных электродах.
NaOH ⇄ Na+ + OH-.
Катод (-): Na+ + 1 ē = Na.
Анод (+): 4OH- - 4 ē = O2↑ + 2H2O.
Пример 3. Электролиз раствора хлорида натрия на инертных электродах.
NaCl ⇄ Na+ + Cl-.
Катод (-): 2H2O + 2ē = H2↑ + 2OH-.
Анод (+): 2Cl- - 2ē = Cl2↑.
В растворе остаются ионы натрия и гидрокид-ионы, т. е. при электролизе образуется гидроксид натрия.
Пример 4. Электролиз раствора сульфата натрия на инертных электродах.
Na2SO4 ⇄ 2Na+ + SO 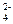 ..
..
Катод (-): 2H2O + 2ē = H2↑ + 2OH-.
Анод (+): 2H2O – 4ē = O2↑ + 4H+.
В этом случае электролизу подвергается вода.
Пример 5. Электролиз раствора сульфата меди на инертных электродах.
CuSO4 ⇄ Cu2+ + SO 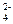 .
.
Катод (-): Cu2+ + 2ē = Cu.
Анод (+): 2H2O – 4ē = O2↑ + 4H+.
Пример 6. Электролиз раствора сульфата меди с медными электродами.
CuSO4 ⇄ Cu2+ + SO 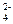 .
.
Катод (-): Cu2+ + 2ē = Cu.
Анод (+): Cu - 2ē = Cu2+.






