Электролиз – это окислительно-восстановительная реакция, протекающая при прохождении постоянного электрического тока через раствор или расплав электролита.
Если в водный раствор электролита или его расплав опустить электроды, соединенные с источником постоянного тока, то хаотичное движение ионов становится направленным: катионы двигаются к катоду (отрицательно заряженному электроду), а анионы – к аноду (положительно заряженному электроду).
С катода электроны переходят к положительно заряженным ионам, в результате чего они превращаются в нейтральные атомы, следовательно, на катоде происходит процесс восстановления. Катод является самым сильным восстановителем.
Отрицательно заряженные ионы отдают электроны аноду и также разряжаются. На аноде происходит процесс окисления.
При пропускании электрического тока через водные растворы солей металлов, имеющих стандартный электродный потенциал больше –0,41 В (потенциал водорода при [H+] = 10-7 моль/л), на катоде восстанавливаются ионы металлов:
Men+ + 2ē = Me.
Если же стандартный электродный потенциал металла меньше –0,41 В, то происходит восстановление молекул воды:
2H2O + 2ē = H2↑ + 2OH-.
В реальных условиях молекулы воды восстанавливаются только при электролизе водных растворов солей очень активных
металлов, расположенных в ряду стандартных электродных потенциалов до алюминия включительно.
Если же водный раствор содержит катионы различных металлов, то при электролизе их выделение на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала, т. е. сначала восстанавливаются Au3+, затем Ag+, Cu2+ и Fe2+..
В кислой среде на катоде восстанавливаются ионы водорода
2H+ + 2ē = H2↑
На аноде происходит окисление анионов или молекул воды. Легче всего окисляются анионы бескислородных кислот (S2-, J-, Br-, Cl-):
2Cl- - 2ē = Cl2.
Если раствор содержит анионы кислородных кислот (SO 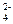 , N
, N 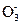 C
C 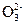 P
P  ), то на аноде окисляются не эти ионы, а молекулы воды с выделением кислорода:
), то на аноде окисляются не эти ионы, а молекулы воды с выделением кислорода:
2H2O – 4ē = O2↑ + 4H+.
В щелочной среде происходит окисление гидроксид-иона с образованием кислорода
4ОН- - 4ē = О2↑ + 2Н2О.
Такие процессы протекают, если электролиз происходит на нерастворимых электродах, т. е. на таких, материал которых не принимает участия в электролизе. Нерастворимые электроды изготавливают из золота, платины или графита.
В случае растворимого анода происходит окисление самого анода. Образовавшиеся ионы металла переходят в раствор и восстанавливаются на катоде, т. е. происходит перенос металла с анода на катод.




