Некоторые вещества при погружении в воду заряжается отрицательно (целлюлоза, шелк, стекло, песок и т. д.). На этом явлении основан метод капиллярного анализа.
Вода поднимается вверх по полоске фильтровальной бумаги, опушенной одним концом в воду. Это поднятие воды по капиллярам бумаги происходит вследствие сил поверхностного натяжения. Если в воде находятся отрицательно заряженные коллоидные частицы, то они не притягиваются капиллярами бумаги и будут двигаться вверх. Если частицы имеют положительный заряд, то они не будут подниматься, и осядут на поверхности бумаги.
Кроме определения знака заряда частиц, капиллярный метод можно применять для анализа смесей различных окрашенных веществ.
Задание 1. Определение знака заряда коллоидных частиц
Получить золы берлинской лазури и гидроксида железа и по 10мл данных золей налить в маленькие стаканчики. Затем в стаканчик с растворами золей опустить одинаковые полоски фильтровальной бумаги так, чтобы бумага не касалась стенок стакана. Через некоторое время измеряют высоту подъема частиц по бумаге и определяют заряд частиц исследуемых золей.
Задание 2. Определение знака заряда частиц красителей
Приготовленные 1-2%-ные растворы красителей по 10мл наливают в стакан и опускают в них полоски фильтровальной бумаги. Через некоторое время измеряют высоту подъема различных красителей и делают заключение о заряде частиц.
Задание 3. Капиллярный анализ с положительно заряженной бумагой
Положительно заряженную бумагу получают путем обработки ее золем гидроксида алюминия АI(ОН)3.
Для приготовления золя АI(ОН)3 к 1% раствору АIСI3 приливают раствор аммиака:
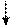 АIСI3 + ЗNH4ОН = АI(ОН)3 + ЗNH4СI
АIСI3 + ЗNH4ОН = АI(ОН)3 + ЗNH4СI
Получившийся осадок АI(ОН)3 промывают на фильтре несколько раз теплой водой. К концу промывания осадок становиться очень вязким. Его переносит в большой стакан емкостью 500мл, наливают ¾ высоты стакана дистиллированной воды и кипятят, добавляя по каплям 0,1Н раствор НСI. Осадок постепенно переходит в золь.
Полученным золем обрабатывают фильтровальную бумагу, погружая ее в раствор на 1-2 часа. Затем бумагу высушивают на воздухе и разрезают на полоски. С такой бумагой проводят опыты, применяя красители, указанные в предыдущих опытах. Полученные во всех трех опытах результаты записывают в таблицу.
| Название золя или красителя | Высота подъема, мм | Знак заряда коллоидных частиц |
| Определение отрицательно заряженной полоской бумаги | Определение положительно заряженной полоской бумаги |
Контрольные вопросы
1. Какими свойствами обладают коллоидные системы?
2. В чем сущность метода капиллярного анализа?
3.Почему положительно заряженные частицы не поднимаются вверх по полоске фильтровальной бумаги?
Лабораторная работа № 26
Коагуляция коллоидных растворов
Цель работы: изучить факторы, обуславливающие коагуляцию и определить порог коагуляции.
Оборудование и реактивы:
· бюретки,
· коническая колба на 250 мл,
· пробирки с делениями,
· штативы с пробирками,
· растворы: FeCl3 -концентрированный; Na3PO4, Na2SO4, СH3СOON4 - 0,02M, дистиллированная вода.
Теоретическое введение
Все коллоидные системы по степени взаимодействия дисперсной фазы с дисперсионной средой делятся на лиофильные и лиофобные.
Лиофильные системы (растворы высокомолекулярных соединений) устойчивы за счет интенсивного взаимодействия двух фаз и образования сольватной оболочки, препятствующей слипанию частиц.
Лиофобные системы отличаются неустойчивостью и склонностью к укрупнению частиц вследствие слабого взаимодействия двух фаз. Основной причиной неустойчивости лиофобных систем является коагуляция, т.е. слипание частиц друг с другом. Процесс коагуляции можно обнаружить по увеличению мутности или изменению цвета коллоидной системы. Коагуляция коллоидных растворов может быть вызвана различными факторами: изменением температуры, облучением, электрическим током, механическим воздействием, введением электролитов. Особо важную роль в процессе коагуляции играют электролиты. Минимальная концентрация электролита, при котором наблюдается коагуляция, называется «порогом коагуляции».
Порог коагуляции С пор выражается в миллимоль на литр и рассчитывается по формуле:
|

|
где
С – молярная концентрация раствора электролита;
V – минимальный объем раствора электролита, необходимый для
коагуляции золя;
Vзоль– объем раствора золя, обычно берут 10 мл золя.
Основные закономерности электролитной коагуляции:
1. Коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду коллоидной частицы. Чем выше заряд иона, тем больше его коагулирующая способность (правило Шульце-Гарди).
2. В ряду органических ионов коагулирующее действие возрастает с повышением адсорбционной способности.
3.  В ряду неорганических ионов одинаковой валентности их коагулирующая активность возрастает с уменьшением гидратации.
В ряду неорганических ионов одинаковой валентности их коагулирующая активность возрастает с уменьшением гидратации.

Zi+ Na+ K+ Rb+2 Cs+

Различают две стадии коагуляции – скрытую и явную.
Первая стадия – скрытая, обычно заканчивается для не органических коллоидов очень быстро и в этот начальный период укрупнения частиц осадка еще не образуется.
Вторая стадия – явная, наступает при дальнейшей агрегации частиц, которая завершается полным разделением системы на две фазы и выпадением частиц или всего коллоидного вещества в осадок.
Экспериментальная часть
Задание 1. Получение золя гидроксида железа (III)
В конической колбе на 250 мл нагрейте на электроплитке до кипения 150 мл дистиллированной воды. Сняв колбу с плитки, влейте в горячую воду 5 мл концентрированного раствора FeСl3. Образуется коллоидный раствор (золь) Fe(ОH)3 красно-коричневого цвета, стабилизированный хлоридом железа (3). Полученный золь охладите до комнатной температуры и используйте в задании 2.
Задание 2. Коагуляция золей электролитами и определение порога коагуляции
Налейте в пробирку 5 мл золя гидроксида железа (3), а в бюретку – 0, 02 М раствор Na3PO4. Из бюретки следует медленно приливать раствор фосфата натрия в пробирку с золем Fe(OH)3 при тщательном перемешивании. Признаком начала коагуляции считается помутнения золя по всему объему раствора.
Повторите опыт, взяв в качестве коагулирующих электролитов Na2SO4 и CH3COONa. Определив пороги коагуляции, данные опытов запишите в таблицу.
Проанализируйте результаты опытов и отметьте, почему коагулирующая способность ионов различна.
| Электролит | Концентрация электролита | Объем электролита, мл. | Объем золя Fe(OH)3 мл. | Коагулирующий ион | Порог коагуляции ммоль/л |
| Na3PO4 Na2SO4 CH3COONa |
Контрольные вопросы
1. Что называют коагуляцией, и какие факторы ее вызывают?
2. В чем заключается правило Шульце – Гарди?
3. Что такое порог коагуляции?
4. Какой объем электролита (мл) 0,01М раствора K2Cr2O7 нужно добавить к 1 мл золя Al(OH)3,чтобы вызвать его коагуляцию? Порог коагуляции- 0,63 м моль/л?
Лабораторная работа № 27
Получение эмульсий и пен, выявление роли стабилизатора
Цель работы: изучить методы получения эмульсий и пен и факторы их устойчивости и разрушения.
Оборудование и реактивы:
· плоскодонные колбы с пробками на 50 мл,
· мерные цилиндры на 10 и 250 мл,
· микроскоп, предметные стекла,
· секундомеры,
· подсолнечное масло, ацетон, вода дистиллированная,
· краситель судан,
· раствор олеата натрия – 2%,
· растворы НСI – 1н и конц.,
· раствор желатина 1%,
· раствор MgSO4 - 30%.
Теоретическое введение
Эмульсии – дисперсные системы, состоящие из двух взаимно нерастворимых жидкостей, одна из которых распределена в другой в виде мельчайших капелек. Обе жидкие фазы эмульсии сильно отличаются по своей природе:
а) одна фаза образована полярной жидкостью (водой) и условно обозначается буквой «в», б) другая фаза образована неполярной жидкостью (бензил, керосин, четыреххлористый углерод и т.д.), она называется маслом независимо от ее природы и обозначается буквой «м».
Существует два типа эмульсий:
1. «Масло в воде» (м/в) – это эмульсия первого рода или прямая, где дисперсная фаза – масло, а дисперсионная среда – вода.
2. «Вода в масле» (в/м) – это эмульсия второго рода или обратная, где дисперсная фаза – вода, а дисперсионная среда – масло.
При изменении условий один тип эмульсии может переходить в другой. Это явление называется обращением фаз эмульсий и для него характерно равновесие:

 в/м м/в.
в/м м/в.
Процесс образования эмульсий можно осуществить двумя методами: диспергированием и конденсацией.
Эмульсии, как и все коллоидные системы, агрегативно неустойчивы из-за избытка свободной энергии на межфазной поверхности, поэтому к ним добавляют стабилизатор, который называют эмульгатором. Роль эмульгаторов играют различные вещества: ПАВ, электролиты, ВМС, твердые вещества в виде порошков. Из всех ПАВ лучшими эмульгаторами являются мыла, например, олеат или стеарат натрия.
Установить тип эмульсии можно несколькими методами, одним из которых является метод окрашивания, основанный на применении красителей, растворимых в масле или воде. Если масло-дисперсная фаза, то при применении красителя (судан III), растворимого в масле, окрашиваются капельки масла. Наблюдение удобно проводить при помощи микроскопа.
На практике нередко возникает важная техническая задача – разрушение эмульсий. Разрушение может быть достигнуто химическим путем. Так, эмульсии первого рода, стабилизированные мылом, можно деэмульгировать, добавляя минеральные кислоты, которые разрушают эмульгатор.
Пены – высококонцентрированные дисперсные системы, состоящие из ячеек, заполненных газом (воздухом, азотом, углекислым газом и т.д.), разделенных очень тонким слоем жидкости. Газ рассматривается в пенах как дисперсная фаза, а жидкость как дисперсная среда.
Пены также термодинамически неустойчивы, поэтому для образования устойчивых высокодисперсных пен в жидкость вводят стабилизатор, называемый пенообразователем. Пенообразователями являются ПАВ – спирты, жирные кислоты, мыла и ВМС (белки). Они снижают поверхностное натяжение и поэтому стабилизируют пену.
Пены могут быть и твердообразными – это строительные материалы (пенобетон, пеностекло, пенопласты), а также продовольственные товары: пастила, зефир, суфле.
Пены получают двумя методами:
1. Диспергированием газа при механическом встряхивании сосуда, частично заполненного раствором пенообразователя.
2. Выделением газа или пара в виде новой дисперсной фазы при кипении жидкости или из перенасыщенного раствора.
Разрушение пен можно вызвать введением пеногасителей – ПАВ, которые не образуют прочных пленок. Они вытесняют пенообразователи из поверхностного слоя, делают его менее прочным и способствуют разрыву стенок пузырьков пен.
Экспериментальная часть
Задание 1. Получить эмульсию методом диспергирования
В две плоскодонные колбочки налить по 10 мл масла. В первую колбочку добавить 10 мл дистиллированной воды, во вторую – 10 мл 2%-ного раствора олеата натрия. Колбочки плотно закрыть пробками и энергично встряхивать (2-5 мин.) до получения эмульсии. Сопоставить устойчивость эмульсий в первой и второй колбочках.
Задание 2. Установить тип эмульсии
Взять капельку полученной устойчивой эмульсии (задание 1), окрасить ее красителем Суданом, поместить на предметное стекло и рассмотреть под микроскопом. Определить, что окрашено: дисперсионная среда или дисперсная фаза. Сделать заключение о типе эмульсии.
Задание 3. Провести обращение фаз эмульсии
Половину эмульсии, стабилизированной олеатом натрия, перенести в чистую колбу и добавить при встряхивании по каплям 0,5 мл 30%-ного раствора MgSO4. Тщательно встряхнуть до образования устойчивой эмульсии. Определить тип эмульсии методом окрашивания.
Задание 4. Разрушить эмульсию химическим путем
В эмульсию, стабилизированную олеатом натрия, добавить по каплям при встряхивании 1н раствор HCl. Что происходит? присутствии различных пенообразователей и
Задание 5. Получить пены методом диспергирования в определить кратность и устойчивость их в зависимости от природы пенообразователя.
В два чистых мерных пронумерованных цилиндра с пробками на 200-250 мл налить по 50 мл водных растворов пенообразователей: раствор олеата натрия и раствор желатина. Цилиндры встряхивать одновременно в течение 30 сек. После прекращения встряхивания включить секундомер и немедленно отметить объем образовавшейся пены в обоих цилиндрах.
Истинный объем пены получают, вычитая из общего объема системы в цилиндре объем оставшегося раствора, затем отмечают время (сек.) самопроизвольного уменьшения объема пен в 2 раза. Данные заносят в таблицу.
| Пенообразователь | Объем, мл | Характеристики пен | |||||
| ПАВ | Объем водного раствора, мл | Концен- трация, вес, % | Пен, V пен | Жид- кости, пошед- шей на пенно-обра-зование, Vж | Жид-кости остав- шейся | Устой- чивость, τ=1/2 сек | Крат-
ность,
Vпены
 Vж Vж
|
| 1. олеат натрия | |||||||
| 2. желатин |
Задание 6. Провести гашение пен различными пеногасителями
Повторным встряхиванием в течение 30 секунд восстановить обильную пену в цилиндре 1, где раствор олеата натрия, и добавить 1-2 капли концентрированной соляной кислоты. Что наблюдается?
Гашение пены во втором цилиндре, где был 1%-ный раствор желатина, провести, добавив 1-2 капли ПАВ (ацетона).
Контрольные вопросы
1. Что называют эмульсиями и пенами?
2. Какие вещества являются эмульгаторами и пенообразователями?
3. Какие два типа эмульсий различают по природе дисперсной фазы?
4. Какие вещества могут вызвать разрушение эмульсии и как они называются?
5. Каковы основные характеристики пен?
6. В чем заключается явление пеногашения?
Лабораторная работа № 28
Изучение явлений набухания и студнеобразования для различных пищевых продуктов
Цель работы: изучить факторы студнеобразования и основные свойства студней.
Оборудование и реактивы:
· пробирки с пробками,
· стаканы на 50 и 200 мл, термометры на 100оС,
· водяная баня,
· пластинки желатина и резины,
· крахмал-порошок,
· раствор желатина-8%,
· бензол, Н2О дистиллированная
Теоретическое введение
Высокомолекулярными соединениями (ВМС) называются такие вещества, молекулы которых состоят из сотен, тысяч и десятков тысяч атомов. Обычно ВМС считаются вещества, у которых молярная масса выше 10 000. По происхождению ВМС подразделяются на природные и синтетические. К числу важнейших природных ВМС растительного и животного происхождения относятся белки (желатин, альбумин), полисахариды (крахмал, агар-агар, целлюлоза, пектиновые вещества), натуральный каучук и др.
Растворы ВМС получают путем растворения их в соответствующих растворителях, например, желатин растворяется в воде, но не растворяется в этиловом спирте, каучук растворяется в бензоле, бензине, но не растворяется в воде. Процесс растворения ВМС своеобразен и отличается от растворения низкомолекулярных веществ. Растворению ВМС предшествует набухание.
Набухание – это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением его массы и объема. Набухание часто является начальным этапом растворения ВМС. Различают ограниченное и неограниченное набухание. Неограниченное набухание – это набухание, заканчивающееся растворением. Так набухают глобулярные белки в воде. Ограниченное набухание – это набухание, которое не переходит в растворение. Так набухают при умеренных температурах желатин и агар-агар в воде.
Способность ВМС к набуханию в различных жидкостях при различных условиях количественно характеризуется степенью набухания. Степень набухания α численно выражается количеством граммов жидкости, поглощенной одним граммом ВМС.
Увеличиваясь при набухании в объеме, ВМС оказывает давление на окружающую среду. Это давление набухающего ВМС называется давлением набухания. Так сухой горох, помещенный в сосуд, заполняемый водой, при набухании может его разорвать.
Набухание – это экзотермический процесс, т. е. сопровождается выделением тепла. Например, при набухании 1г сухого желатина выделяется 27,93 Дж тепла, а 1г крахмала – 32,3 Дж.
Растворы ВМС и некоторые коллоидные системы способны при известных условиях терять текучесть и застудневать, образуя при этом студни.
В студнях частицы дисперсной фазы связаны между собой в сетчатый каркас, а дисперсионная среда заключена в промежутках между ними. Таким образом, студни – это структурированные системы со свойствами эластичных твердых тел. Студни ВМС могут быть получены в основном двумя путями: методом застудневания растворов полимеров и методом набухания сухих ВМС в соответствующих жидкостях.
охлаждение

 раствор полимера концентрирова- студень ограни- полимер
раствор полимера концентрирова- студень ограни- полимер
ние, прибавление чение
электролита набухания
Для студней характерен ряд свойств твердых тел: они сохраняют форму, обладают упругими свойствами и эластичностью. При нагревании студни переходят в вязкотекучее состояние. Этот процесс называется плавлением. Многие студни способны разжижаться и переходить в растворы при механическом воздействии (перемешивание, встряхивание), а в состоянии покоя вновь застудневать. Свойства студней многократно изотермически разжижаться при механических воздействиях и застудневать в состоянии покоя называется тиксотропией.
Свежеприготовленные студни с течением времени подвергаются изменениям, так как процесс структурирования в студне продолжается. При этом на поверхности студня начинают появляться капельки жидкости, которые, сливаясь, образуют жидкую среду. Такой самопроизвольный процесс разделения студня на две фазы, сопровождающийся изменением объема студня при сохранении общей формы, называется синерезисом (отмоканием).
Экспериментальная часть
Задание 1. Исследовать набухание желатина и каучука (резины) в различных жидкостях
Прямоугольные пластинки желатина и каучука или резины длиной 5 см, шириной 0,3 см поместить в узкие пробирки с дистиллированной водой, а две другие такие же пластинки – в пробирки с бензолом.
Все пробирки плотно закрыть пробками и положить горизонтально.
Через 1 час наложить пробирки на полоски миллиметровой бумаги, измерить длину пластинок и определить изменение пластинок вследствие набухания.
Набухают только лиофильные к данной жидкости вещества (желатин – в воде, резина – в бензоле).
Задание 2. Изучить зависимость времени студнеобразования о температуры и концентрации раствора
Горячий 8%-ный раствор желатина или крахмала разбавить водой, получив 8; 4; 2% растворы.
Налить по 5 мл этих растворов в одинаковые пробирки и поместить их в большой сосуд с холодной водой известной температуры (лучше 10оС) и заметить время. Периодически наклоняя пробирки установить время студнеобразования по образованию невытекающего студня. Вычертить кривую зависимости времени студнеобразования от концентрации раствора.
Нагрев пробирки на водяной бане до плавления студней, погружают их в сосуд с ледяной водой (0оС) и опять определяют время студнеобразования.
Задание 3. Наблюдать выделение тепла при набухании
В стаканчике размешать 5г предварительно хорошо высушенной при 105оС и охлажденной до комнатной температуры крахмала с 5 л воды. В смесь погрузить термометр и наблюдать повышение температуры смеси.
Контрольные вопросы
1. Что называют студнями?
2. Какие факторы влияют на процесс студнеобразования?
3. В чем заключается явление синерезиса?
4. В чем сущность набухания? Чем оно отличается от простого поглощения жидкости твердым телом?
Приложения
| Периодическая таблица элементов (таблица Менделеева) | He 4.003 | Ne 20.18 | Ar 39.95 | Kr 83.80 | Xe 131.3 | Rn (222) | Lu 175.0 | Lr (262) | ||
| F 19.00 | Cl 35.45 | Br 79.90 | I 126.9 | At (210) | Yb 173.0 | No (259) | ||||
| O 16.00 | S 32.07 | Se 78.96 | Te 127.6 | Po (209) | Tm 168.9 | Md (258) | ||||
| N 14.01 | P 30.97 | As 74.92 | Sb 121.8 | Bi 209.0 | Er 167.3 | Fm (257) | ||||
| C 12.01 | Si 28.09 | Ge 72.59 | Sn 118.7 | Pb 207.2 | Ho 164.9 | Es (252) | ||||
| B 10.81 | Al 26.98 | Ga 69.72 | In 114.8 | Tl 204.4 | Dy 162.5 | Cf (251) | ||||
| Zn 65.39 | Cd 112.4 | Hg 200.6 | Tb 158.9 | Bk (247) | ||||||
| Cu 63.55 | Ag 107.9 | Au 197.0 | Gd 157.3 | Cm (247) | ||||||
| Ni 58.69 | Pd 106.4 | Pt 195.1 | Eu 152.0 | Am (243) | ||||||
| Co 58.93 | Rh 102.9 | Ir 192.2 | Sm 150.4 | Pu (244) | ||||||
| Fe 55.85 | Ru 101.1 | Os 190.2 | Pm (145) | Np (237) | ||||||
| Mn 54.94 | Tc (98) | Re 186.2 | Nd 144.2 | U 238.0 | ||||||
| атомный номер символ элемента относительная атомная масса | Cr 52.00 | Mo 95.94 | W 183.9 | (263) | Pr 140.9 | Pa (231) | ||||
| V 50.94 | Nb 92.91 | Ta 180.9 | (262) | Ce 140.1 | Th 232.0 | |||||
| Ti 47.88 | Zr 91.22 | Hf 178.5 | (261) | *Лантаниды | **Актиниды | |||||
| Sc 44.96 | Y 88.91 | La* 138.9 | Ac** (227) | |||||||
| Be 9.012 | Mg 24.31 | Ca 40.08 | Sr 87.62 | Ba 137.3 | Ra (226.0) | |||||
| H 1.008 | Li 6.941 | Na 22.99 | K 39.10 | Rb 85.47 | Cs 132.9 | Fr (223) |






