V = k x CAa x CBb, где
V – скорость реакции;
CA и CB – молярные концентрации веществ А и В;
k – константа скорости, зависит от природы реагирующих веществ, но не зависит от концентрации реагирующих веществ;
а и b – стехиометрические коэффициенты.
На скорость реакции сильное влияние оказывает изменение температуры. При повышении температуры увеличивается скорость химических реакции, так как возрастает количество активных молекул и число их столкновений в единицу времени.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2 – 4 раза.
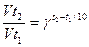 , где
, где
Vt2 и Vt1 - скорость при температурах t2 и t1;
γ - температурный коэффициент реакции.
Кроме концентрации и температуры на скорость химической реакции оказывают влияние действие катализаторов, поверхность соприкосновения реагирующих веществ и другие факторы.
Экспериментальная часть
Изменение скорости химической реакции от концентрации реагирующих веществ и от температуры удобно проследить на реакции взаимодействия тиосульфата натрия Na2S2O3 c серной кислотой H2SO4.
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
Выделяющаяся сера вызывает помутнение раствора. Время, которое проходит от момента сливания двух веществ до заметного помутнения раствора, зависит от концентрации реагирующих веществ и температуры и может характеризовать относительную скорость реакции. Чем быстрее наступает помутнение раствора, тем больше скорость данной реакции.
Задание 1. Исследовать зависимости скорости реакции от концентрации реагирующих веществ
В трех пронумерованных пробирках (1, 2, 3) приготовьте раствор тиосульфата натрия Na2S2O3 различной концентрации из исходного раствора и воды. Для этого с помощью измерительных пробирок в каждую пробирку налейте:
в первую – 3 мл раствора Na2S2O3;
во вторую – 2 мл раствора Na2S2O3 и 1 мл H2O;
в третью – 1 мл раствора Na2S2O3 и 2 мл H2O.
В три другие пробирки налейте по 1 мл раствора серной кислоты H2SO4.
Затем в каждую пробирку с приготовленным раствором тиосульфата натрия Na2S2O3 добавьте по 1 мл приготовленного раствора серной кислоты H2SO4 и точно по секундомеру отметьте, через какое время наблюдается помутнение раствора.Результаты запишите в таблицу 1.
Таблица 1. Опыт 1
| № пробирки | Объем, мл | Относительная концентрация Na2S2O3 | Время появления мути, сек. | Скорость реакции V=1/t | ||
| Na2S2O3 | H2O | H2SO4 | ||||
| - | ||||||
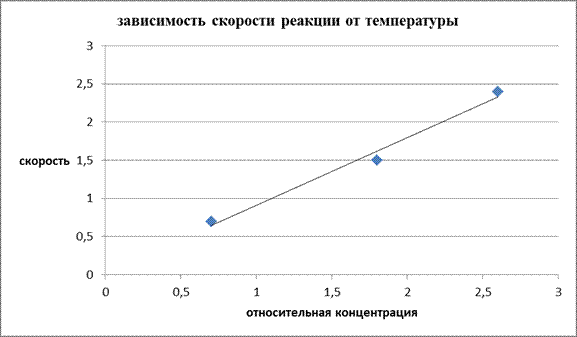
Изобразите полученные результаты графически, отложив на оси абсцисс относительную концентрацию Na2S2O3 (мл), а на оси ординат – скорость реакции V=1/t. Масштаб по осям координат равномерный.
По отношению у/х определить константу скорости реакции.
Задание 2. Исследовать зависимость скорости реакции от температуры
Изучение скорости реакции взаимодействия тиосульфата натрия с серной кислотой проводите при трех температурах, отличающихся на 100С.
В три нумерованные пробирки (1, 2, 3) налейте по 2 мл раствора Na2S2O3, а три другие – по 2 мл раствора H2SO4.
Каждую пару пробирок поместите в стакан с водой и выдержите 3 минуты при заданной температуре t10С, которую измерьте термометром. Затем содержание пробирок слейте в одну пробирку, отсчитайте с помощью секундомера время от момента сливания до помутнения раствора.
Проделайте опыт с другими парами пробирок при температуре t20С, а затем при температуре t30С.
Данные опытов запишите в таблицу 2.
Таблица 2. Опыт 2.
| № опыта | Температура, t0С, | Время появления мути, t сек. | Скорость реакции V=1/t |
Изобразите графически полученные результаты, отложив на оси абсцисс температуру, а на оси ординат – скорость реакции V=1/t. Масштаб по осям координат равномерный.
Рассчитайте температурный коэффициент скорости реакции Y по формуле:
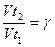
Контрольные вопросы
1. Напишите математические выражения для скоростей следующих химических реакций:
а) N2(г) + O2(г) = 2NO(г)
б) CH4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
в) 2Н2S(г) + 3O2(г) = 2SO2(г) + 2Н2О(г)
г) Fe2O3(к) + 3H2(г) = Fe(к) + 3Н2О(г)
2. Реакция между веществами SO2 и O2 выражается уравнением:
2 SO2(г) + O2 = 2SO3(ж)
Начальная концентрация SO2 равна 0,5 моль/л, а O2 – 0,3 моль/л, константа скорости k = 0,4. Чему равна скорость реакции в начальный момент?
3. Как возрастет скорость реакции при повышении температуры с 100С до 400С, если температурный коэффициент скорости реакции равен 2?
Лабораторная работа № 22
Исследование химического равновесия и условий его смещения
Цель работы: изучить влияние различных факторов на химическое равновесие.
Оборудование и реактивы:
· химические стаканы,
· пробирки,
· насыщенные растворы FeCI3, NH4CNS,
· сухая соль NH4CI,
· дистиллированная вода.
Теоретическое введение
Химическое равновесие – это состояние обратимого процесса, при котором скорости прямой (Vпр.) и обратной (Vобр.) реакций равны.
аА + bВ = сАВ
Vпр. = Vобр
kпр * [A]a x [B]b = kобр.* [AB]c
где [A], [B], [AB] – равновесные концентрации, моль/л;
a, b, c – стехиометрические коэффициенты.
Отношение kпр /kоб= Кр называется константой равновесия. Она зависит только от природы реагирующих веществ и от температуры, но не зависит от концентрации реагирующих веществ, от присутствия катализатора и внешнего давления.
Величина Кр количественно характеризует состояние равновесия: чем больше Кр, тем больше концентрация продуктов реакции в момент равновесия:
Кр = 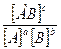
Химическое равновесие нарушается при изменении условий протекания реакций: изменение концентрации какого-либо из веществ, участвующих в реакции, давления или температуры. В соответствии с принципом Ле Шателье:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие извне, то в результате протекающих в ней процессов, равновесие сместится в таком направлении, что оказанное воздействие уменьшается.
Экспериментальная часть
Задание. Исследовать влияние изменения концентрации реагирующих веществ на химическое равновесие
Реакция между хлоридом железа (III) FeCI3 и роданидом аммония NH4CNS выражается уравнением:
FeCI3 + 3NH4CNS = Fe(CNS)3 + 3NH4CI
желтый прозрачный темно-красный прозрачный
раствор раствор раствор раствор
Напишите выражение константы равновесия данной реакции.
В стаканчик налейте 40 мл дистиллированной воды и добавьте по 1-2 капли насыщенных растворов FeCI3 и NH4CNS. Образуется раствор красного цвета. По изменению интенсивности этой окраски можно судить о направлении смещения равновесия в ту или иную сторону.
Полученный раствор разлейте в 4 пробирки поровну. В первую пробирку добавьте 2-3 капли насыщенного раствора FeCI3, во вторую – 2-3 капли насыщенного раствора NH4CNS, в третью – несколько кристалликов NH4CI.
Сравните окраску растворов во всех трех пробирках с контрольной смесью в четвертой пробирке, в которой находится исходный раствор. По изменению интенсивности окраски определите направление смещения равновесия.
Дайте объяснения наблюдаемым явлениям, пользуясь выражением константы химического равновесия и принципом Ле Шателье.
Результаты опыта занесите в таблицу.
Таблица
| № пробирки | Что добавили | Изменение интенсивности окраски | Направление смещения равновесия |
Контрольные вопросы
1. Что называют химическим равновесием?
2. Каков физический смысл константы равновесия?
Лабораторная работа № 23
Определение pH водных растворов электролитов
Цель работы: ознакомить студентов с методом pH - метрии и применением его для анализа продовольственных товаров.
Оборудование и реактивы:
pH - метр лабораторный,
индикаторы фенолфталеин и метилоранж,
растворы солей NaCI, Na2Co3, NH4CI, раствор HCI, раствор NaOH,
универсальная индикаторная бумага,
фильтровальная бумага, стаканы на 50-100 мл.
Теоретическое введение
Точные измерения показывают, что чистая дистиллированная вода в незначительной мере электропроводна, она имеет ионный характер проводимости, следовательно, вода в незначительной мере диссоциирована, что можно представить уравнением:

 H2O H+ + OH–
H2O H+ + OH–
В соответствии с законом действия масс, для обратимого процесса диссоциации воды константа диссоциации K выражается уравнением:
K = 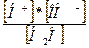 =1,8×10–16
=1,8×10–16
где [Н+] и [ОН–] - равновесные концентрации Н+ и ОН- моль/л,
[Н2О] - равновесная концентрация недиссоциированных молекул воды, моль/л. Принимая во внимание, что вода практически не диссоциирована (из 555 миллионов молекул воды диссоциирует только одна), можно допустить, что равновесная концентрация молекул воды равна общей концентрации воды т.,
[H2O] = 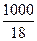 =55,55 моль/л
=55,55 моль/л
тогда [H+] × [OH–] = K × [H2O] = 1,8 × 10–16 × 55,56 =10–14
т.е.[H+] × [OH–] = 10–14 — ионное произведение воды
Произведение концентрации ионов водорода и ионов гидроксила для воды при постоянной температуре (22○С) есть величина постоянная и называется ионным произведением воды Кв.
Растворы, в которых концентрация ионов H+ равна концентрации ионов OH–, называются нейтральными растворами. В растворе кислоты концентрация ионов H+ всегда больше концентрации ионов OH–. В щелочном растворе концентрация ионов водорода меньше концентрации ионов гидроксила. По концентрации ионов водорода можно судить о характере среды.
[H+] = [ОН–] = 10–7 - нейтральная среда
Н+] > 10–7 > [ОН–] - кислая среда
[Н+] < 10–7 < [ОН–] - щелочная среда.
Охарактеризовать кислотность или щелочность среды раствора числами с отрицательными показателями степени очень неудобно, поэтому ввели водородный показатель pH.
рН = – lg [H+]
в нейтральной среде pH = 7,
в кислой среде pH < 7,
в щелочной среде pH > 7
Следует различать общую и активную кислотность.
Общая кислотность определяется нормальной концентрацией раствора N, т.е. числом эквивалентов кислоты в объеме раствора. Но так как не все кислоты являются сильными электролитами, то количество свободных ионов [H+] может быть меньше теоретически возможного.
Под активной кислотностью понимают концентрацию свободных гидратированных ионов водорода.






