Бюретку заполнить раствором перманганата калия до нулевого деления, отсчет ведут по верхнему мениску, т.к. раствор имеет темную окраску.
Пипетку ополаскивают раствором 0,05н щавелевой кислоты.
Раствор щавелевой кислоты объемом 10 мл переносят в колбу для титрования, туда же цилиндром добавляют 8-10 мл 2н раствора серной кислоты для создания кислой среды.
Раствор нагревают на водяной бане до 60-70 °С, горячий раствор щавелевой кислоты титруют раствором перманганата калия медленно, по каплям, при непрерывном перемешивании, каждую каплю добавляют после того, как обесцветится предыдущая капля. Сначала розовый раствор перманганата калия обесцвечивается медленно, а затем быстрее по мере образования сульфата марганца (катализатора).
Если от прибавления 1 капли перманганата калия розовая окраска не исчезает в течение одной минуты, титрование прекращают. Записывают объём раствора перманганата калия в лабораторную тетрадь. Титрование выполняют ещё раз. Из двух полученных объёмов раствора берут среднее значение для расчетов.
Нормальность раствора перманганата калия определяют по формуле:
V (Н2С2О4)* С(1/2 Н2С2О4)
 С(1/5 КМnО4) =;
С(1/5 КМnО4) =;
V(КМnО4)
С(1/5 КМnО4) - нормальность перманганата калия, н;
С(1/2 Н2С2О4) - нормальность раствора щавелевой кислоты 0,05н;
V(КМnО4) - объём перманганата калия, израсходованный на титрование, мл;
V (Н2С2О4)* - объём раствора щавелевой кислоты, 10 мл.
Контрольные вопросы
1. Что является индикатором в перманганатометрии?
2. Сколько граммов перманганата калия необходимо взять для приготовления 5 литров 0.5 Н раствора?
Лабораторная работа № 19
Определение общей жесткости воды
Цель работы
изучить сущность метода комплексонометрии и овладеть основными операциями его выполнения.
Оборудование и реактивы:
· бюретки;
· пипетки на 50 мл;
· мерные цилиндры на 25 мл или мерные пробирки;
· колбы для титрования аммиачно-буферный раствор;
1. раствор трилона Б 0,05н;
2. индикатор эриохром черный Т;
3. вода для определения жесткости.
Теоретическое введение
Методами комплексонометрии называют такие методы титриметрического анализа, которые основаны на реакциях комплексообразования.
В качестве комплексонов применяют производные аминополикарбоновых кислот, которые образуют прочные комплексные соединения с различными катионами. Наибольшее применение в комплексонометрии имеют этилендиаминтетрауксусная кислота и ее замещенная натриевая соль, которую называют трилоном Б или комплексоном III.

 НООСН2С СН2СООNa
НООСН2С СН2СООNa

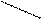 N-СН2-СН2-N
N-СН2-СН2-N
NaООСН2С СН2СНООН
Трилон Б образует растворимые внутрикомплексные соли со многими катионами, при этом катион замещает атомы водорода карбоксильных групп
(-СООН), а также связывается координационной связью с атомами азота:

 НООСН2С СН2СООNa
НООСН2С СН2СООNa

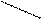 N-СН2-СН2-N +Ме2+→
N-СН2-СН2-N +Ме2+→
NaООСН2С СН2СНООН



 Ме2 +
Ме2 +
 |  |

 ООСН2С СН2СООNa
ООСН2С СН2СООNa

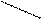 → N-СН2-СН2-N +2Н+
→ N-СН2-СН2-N +2Н+
 NaООСН2С СН2СНОО
NaООСН2С СН2СНОО
Образующиеся комплексные соединения очень прочные. Трилон Б используется для определения многих ионов: Ca2+, Mg2+, Zn2+, Cu2+, Ni2+, Al3+, и д.р.
Точку эквивалентности в методе комплексонометрии устанавливают с помощью металлиндикаторов. К ним относятся мурексид, эриохром черный Т и др. Эти индикаторы, являясь органическими красителями, образуют окрашенные комплексные соединения с катионами определяемых элементов:
Mе2+ + НInd2- D MеInd- + Н+
синий винно-красный
Получаемые при этом комплексные соединения менее устойчивы, чем внутрикомплексные соли, образуемые определяемыми катионами с комплексонами. Поэтому в процессе титрования комплексоном исследуемого раствора окрашенное комплексное соединение индикатора с катионом металла постепенно разлагается вследствие образования нового, более прочного внутрикомплексного соединения с комплексоном. В точке эквивалентности первоначальный цвет комплексного соединения, образуемого индикатором с определяемым катионом, исчезает и появляется окраска, свойственная свободному индикатору:
MеInd- + [Н2Tr]2- → НInd2- +[MеTr]2- + Н+
винно-красный синий бесцветный
Для поддержания рН раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь.
Комплексонометрическое определение общей жесткости воды заключается в титровании солей кальция и магния, содержащихся в исследуемой воде и обуславливающих ее жесткость, трилоном Б в присутствии эриохрома черного при рН = 9.
Общая жесткость воды вычисляется по формуле:
С(1/2Na2Н2Tr)* V(Na2Н2Tr) * 1000
 Ж =, ммоль/л
Ж =, ммоль/л
Vводы
С(1/2Na2Н2Tr)- нормальная концентрация трилона Б;
V(Na2Н2Tr) - объем трилона Б, израсходованного на титрование, мл;
Vводы - объем исследуемой воды, мл.
Ж - общая жесткость воды, ммоль/л;
Экспериментальная часть






