Первое начало термодинамики это закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы. Оно утверждает: "Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме механических эквивалентов всех внешних воздействий".
Математически первое начало термодинамики можно записать так:
dU=dQ-dA+dM,
где dU – изменение внутренней энергии системы;
dQ – элементарное количество тепла, подводимого к системе;
dA – элементарная работа, совершаемая системой;
dM – другие виды элементарных энергий.
Если dM=0, то
dU=dQ-dA или dQ=dU+dA.
Изотермический процесс – процесс, протекающий при постоянной температуре (T=const).
Первое начало термодинамики для изотермического процесса. Т.к. dU=CVdT=0, то U=const, а
dQ=dU+dA=dA,
т.е. все подводимое к системе тепло идет на совершение этой системой работы.
Работа, совершаемая идеальным газом при изотермическом процессе:
а) для моля или киломоля идеального газа:
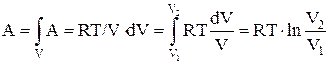
или
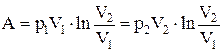 ;
;
б) для произвольной массы газа:

или
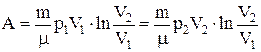 ;
;
Изобарический процесс – процесс, протекающий при постоянном давлении (p=const).
Первое начало термодинамики для изобарического процесса:
dQp=dU+dA,
т.е. подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы. При этом
а) для моля или киломоля идеального газа
dQp=CpdT, dU=CVdT, dA=pdV=RdT;
б) для произвольной массы газа:
dQp=mCpdT/μ, dU=mCVdT/μ, dA=mpdV/μ=mRdT/μ;
Доля подводимой к системе энергии, которая идет на совершение работы:
dA=R/Cp×dQp=(1-1/g)dQp=dQp×(g-1)/g.
Доля подводимой к системе энергии, которая идет на изменение внутренней энергии системы:
а) для моля или киломоля идеального газа:
dU=CVdT=dQp CV/Cp=dQp/g;
б) для произвольной массы газа:
dU=mCV×dT/μ=m×dQpCV/μCp=mdQp/μg;
где g=Cp/CV.
Изохорический процесс – процесс, протекающий при постоянном объеме (V=const).
Первое начало термодинамики для изохорического процесса:
Т.к. dA=p×dV=0, то
dQV=dU+dA=dU,
т.е. при изохорическом процессе, все подводимое к системе тепло идет на изменение ее внутренней энергии. При этом
dQV=CVdT,
следовательно,
dU=CVdT, или DU=CvDT.
Изменение внутренней энергии системы пропорционально изменению ее температуры.
Адиабатические или адиабатные процессы – процессы, протекающие без теплообмена или почти без теплообмена с окружающей средой. Примером адиабатического процесса может служить быстро протекающий процесс сжатия или расширения газа.
Первое начало термодинамики для адиабатического процесса: т.к. dQ=0, то
dU+dA=0, a dA=-dU,
т.е. работа, совершаемая системой при адиабатическом процессе, сопровождается уменьшением ее внутренней энергии.
Связь между параметрами состояния системы при адиатическом процессе (уравнения Пуассона):
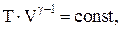
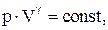
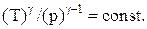
Работа, совершаемая произвольной массой m идеального газа при адиабатическом расширении:
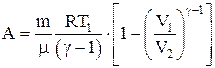
Политропическим называют процесс, при котором p и V связаны соотношениями:
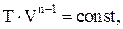
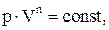
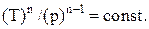
где n - показатель политропы, принимающий любые значения от -¥ до +¥.
Работа, совершаемая идеальным газом при политропическом процессе,

Обратимый процесс, это процесс, который протекает так, что после его окончания систему можно вернуть в первоначальное состояние, причем ни каких изменений в окружающей систему среде не произойдет.
Необратимый процесс, это процесс, протекающий так, что после его окончания систему нельзя вернуть в первоначальное состояние без изменений в окружающей среде.
Круговой процесс (цикл), это такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь.
Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия – работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла.
Если работа при расширении больше, чем работа при сжатии, то такой процесс (цикл) называется прямым. В противном случае – обратным.
Коэффициент полезного действия при куруговых процессах (характеристика эффективности цикла) – физическая величина, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе:

Цикл Карно – состоит из двух изотермических и двух адиабатических процессов.
Коэффициент полезного действия цикла Карно (КПД):
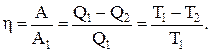
КПД цикла Карно не зависит от природы вещества, а зависит лишь от температур, при которых теплота, сообщается системе и отбирается от нее.
Коэффициент полезного действия холодильной машины (холодильника)
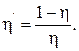
Примечание. Кроме цикла Карно в технической термодинамике применяются цикл Отто, состоящий из двух адиабатических и двух изохорических процессов, и цикл Дизеля, состоящий из двух адиабатических, изохорического и изобарического процессов.
Энтропия – физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс:
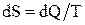 .
.
Связь энтропии системы с термодинамической вероятностью (соотношение Больцмана):
S=k×lnw,
где k – постоянная Больцмана.






