Пример 1. Задача на разбавление.
Какой объем 95%-ного раствора серной кислоты (r =1,84 г/мл) надо взять для приготовления 400г 10%-ного раствора кислоты?
Приготовление раствора означает, что концентрированный раствор разбавляют водой. При этом остается неизменной масса растворенного вещества.
Кратко запишем условия задачи, обозначив параметры исходного раствора с индексом 1, приготовляемого раствора с индексом 2.
 Дано: Решение:
Дано: Решение:
С% 1=95% · Из выражения для процентной концентрации r1 =1,84 г/мл приготовляемого раствора выразим необходимую
m 2 Р-РА=400 г массу растворенного вещества (серной кислоты):
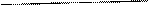 C% 2=10%
C% 2=10% 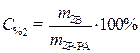
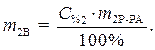 (1)
(1)
Найти: V 1=? · Определяем массу серной кислоты (m 1В) в исходном растворе: 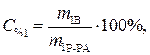 так как m 1Р-РА = V 1 ·ρ 1, то
так как m 1Р-РА = V 1 ·ρ 1, то
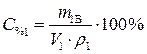
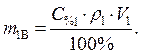 (2)
(2)
· Поскольку m 1В= m 2В, то приравниваем выражения (1) и (2).
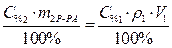
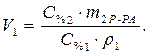
· Расчет 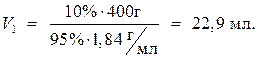
Ответ: объем 95%-ного раствора серной кислоты равен 22,9 мл.
Пример 2. Задача с расчетом по уравнению химической реакции.
Какая масса 25%-ного раствора гидроксида калия расходуется на нейтрализацию 75 г 15%-ного раствора уксусной кислоты?
Обозначим параметры, относящиеся к уксусной кислоте, индексом 1, гидроксиду калия – индексом 2.
 Дано: Решение:
Дано: Решение:
C% 1= 15% · Уравнение реакции нейтрализации:
m 1 Р-РА=75 г СH3COOH + KOH = CH3 COOK + H2O
C% 2= 25% · Рассчитаем массу растворенного вещества,
содержащегося в растворе уксусной кислоты: 
Найти: m 2Р-РА=?
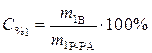
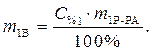
· Определяем количество вещества (уксусной кислоты), содержащееся в растворе:
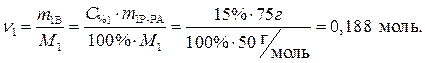
· По уравнению реакции 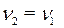 . Рассчитаем
. Рассчитаем 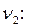
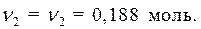
· Найдем массу растворенного вещества, содержащегося в растворе гидроксида калия: 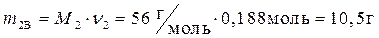
· Определяем массу раствора гидроксида калия, содержащего данное количество растворенного вещества – гидроксида калия:
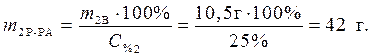
Ответ: 42 г – масса раствора гидроксида калия, которая расходуется на реакцию с уксусной кислотой.
Пример 3. Задача на приготовление раствора соли из кристаллогидрата
В 450 г воды растворили 50 г CuSO4×5H2O. Вычислить процентное содержание кристаллогидрата (CuSO4×5H2O) и безводной соли (CuSO4) в растворе.
Обозначим параметры раствора кристаллогидрата с индексом 1, раствора безводной соли с индексом 2.
 Дано: Решение:
Дано: Решение:
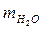 =450г · Найдем общую массу раствора:
=450г · Найдем общую массу раствора:
 m 1В = 50г m Р-РА = m 1Р-РА = m 2Р-РА =
m 1В = 50г m Р-РА = m 1Р-РА = m 2Р-РА = 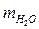 + m 1В.
+ m 1В.
Найти: m Р-РА = 450г + 50г = 500 г.
С% 1, С% 2 =?
· Рассчитаем процентное содержание кристаллогидрата в растворе:
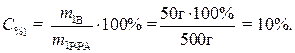
· Определим массу безводной соли в растворе:
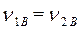
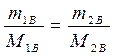
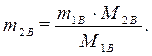
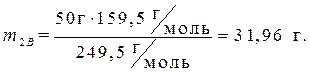
· Процентное содержание безводной соли в растворе:
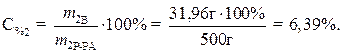
Ответ: 10% – содержание кристаллогидрата в растворе, 6,39% – содержание безводной соли в растворе.
Пример 4. Задача на расчет молярной концентрации, если известна процентная концентрация.
 Определить молярную концентрацию 36,2% - го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Определить молярную концентрацию 36,2% - го (по массе) раствора соляной кислоты, плотность которого равна 1,18 г/мл.
Дано: Решение:
С% = 36,2 % · Из выражения для процентной
r = 1,18г/мл концентрации данного раствора выразим
 необходимую массу растворенного вещества
необходимую массу растворенного вещества
(соляной кислоты):
Найти: СМ =? 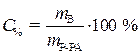
· Подставляем массу соляной кислоты (mВ) в формулу, выражающую молярную концентрацию раствора и, учитывая, что mР-РА = V · ρ, записываем формулу перехода от процентной концентрации к молярной:
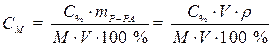 . (2)
. (2)
· Для приведения размерности применяемых величин в соответствие выразим плотность раствора в г/л r =1,18·103г/л, тогда объем раствора получится в литрах и сокращается, формула приобретает следующий вид:
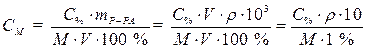 . (3)
. (3)
· Производим расчет, используя формулу (3) для перехода от процентной концентрации к молярной:
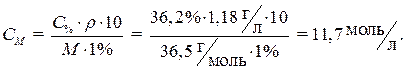
Ответ: 11,7моль/л.
Пример 5. Задача на определение процентной концентрации, если известна молярная концентрация раствора.
 Определить процентное содержание растворенного вещества в 1,68 М растворе H2SO4, плотность которого равна 1,1 г/мл.
Определить процентное содержание растворенного вещества в 1,68 М растворе H2SO4, плотность которого равна 1,1 г/мл.
Дано: Решение:
СМ = 1,68 моль/л · Расчет произведем, используя формулу из табл.3.2
 r = 1,1г/мл для перехода от молярной концентрации к процентной
r = 1,1г/мл для перехода от молярной концентрации к процентной
(вывод формулы можно произвести самостоятельно,
Найти: С% =?используя пример 4):
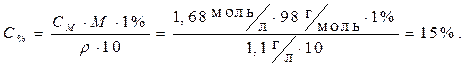
Ответ: 15 %.
Тема №6: «Гидролиз солей»
Задание 1. Напишите в молекулярной и ионной формах уравнения гидролиза солей, укажите значения рН растворов этих солей (больше или меньше 7).
Задание 2. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза солей.
| Задание 1. | Задание 2. |
| 1. NaNO2, Cu(NO3)2 | 1. Fe2(SO4)3 + Na2CO3 |
| 2. AlCl3, NaHCO3 | 2. Na2S + Al2(SO4)3 |
| 3. Na3PO4, ZnCl2 | 3. SnCl2 + K2SO3 |
| 4. FeCl2, K2S | 4. Cr2(SO4)3 + K2S |
| 5. K2SO3, ZnSO4 | 5. K2CO3 + Bi(NO3)3 |
| 6. NH4Cl, KClO | 6. Na2S + AlCl3 |
| 7. Na2Se, MnCl2 | 7. FeCl3 + K2CO3 |
| 8. ZnSO4, BaS | 8. Cr2(SO4)3 + Na2SO3 |
| 9. Ni(NO3)2, KNO2 | 9. K2SO3 + AlBr3 |
| 10. NH4Br, Na2S | 10. Bi(NO3)3 + Na2CO3 |
| 11. Na2HPO4, Mg(NO3)2 | 11. CrCl3 + K2S |
| 12. Al2(SO4)3, Na2SeO3 | 12. Na2CO3 + Cr(NO3)3 |
| 13. CuSO4, K3PO4 | 13. K2SiO3 + Bi(NO3)3 |
| 14. Na2SO3, Fe2(SO4)3 | 14. Na2SO3 + CrCl3 |
| 15. NaCN, FeSO4 | 15. Be(NO3)2 + Na2SO3 |
| 16. Ba(CH3COO)2, CoSO4 | 16. AlCl3 + Na2SO3 |
| 17. NiSO4, NaF | 17. SnCl2 + Na2CO3 |
| 18. Pb(NO3)2, Ba(NO3)2 | 18. Na2S + Al2(SO4)3 |
| 19. Cr2(SO4)3, NaCH3COO | 19. Fe(NO3)3 + K2CO3 |
| 20. KHS, MgSO4 | 20. Al2(SO4)3 + Na2CO3 |
| 21. CdCl2, NaClO | 21. Na2SO3 + SnCl2 |
| 22. Cr(NO3)3, K2CO3 | 22. NH4Cl + Na2SiO3 |
| 23. KHSO3, MnSO4 | 23. K2SO3 + CrCl3 |
| 24. Li2S, CrCl3 | 24. AlBr3 + Na2SO3 |
| 25. SrS, SnBr2 | 25. BeCl2 + Na2S |
| 26. Ca(HCO3)2, CuBr2 | 26. BeCl2 + Na2SO3 |
| 27. Li2SO3, AlCl3 | 27. Fe2(SO4)3 + K2SO3 |
| 28. Zn(NO3)2, К3PO4 | 28. Na2S + Al(NO3)3 |
| 29. (NH4)2SO4, RbHSO3 | 29. SnCl2 + Na2SO3 |
| 30. SnSO4, KF | 30. SnCl2+ K2CO3 |






