| Процессы | Среда в окислительно-восстановительных реакциях в расчете на "О2– " в соединении | ||
| кислая (Н+) | щелочная (ОН-) | нейтральная (Н2О) | |
| Связать "О2– " NO3–® NO2– | О2– + 2Н+ = Н2О | О2– + Н2О = 2ОН– | О2– + Н2О = 2ОН– |
| Ввести "О2–" SO32– ® SO42– | Н2О = О2– + 2Н+ | 2ОН – = О2– + Н2О | Н2О = О2– + 2Н+ |
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
На границе металл-раствор возникает электрохимический потенциал, называемый электродным. В данном случае металлический электрод непосредственно участвует в реакции
Me – ne 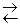 Men+.
Men+.
Величина потенциала зависит от природы, концентрации веществ, участвующих в электродном процессе, от температуры и находится по уравнению Нернста:
j = j0 + 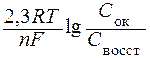 ,
,
где j0 – стандартный потенциал, В;
R – универсальная газовая постоянная (8,31 Дж/(моль·К));
Т – абсолютная температура, К;
n – число электронов, участвующих в электродном процессе;
F – число Фарадея (96500 Кл/моль);
Сок и Свосст – произведения концентраций (активностей) веществ, моль/л, принимающих участие в соответствующей полуреакции в окисленной и восстановленной формах.
После подстановки значений R, F и T = 298 К электродный потенциал металла в растворе его соли равен:
j = j0 + 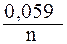 lg [Men+].
lg [Men+].
Из двух электродов, погруженных в раствор своей соли, можно составить систему, которая называется гальваническим элементом. В нем химическая энергия ОВР превращается в электрическую. Электрод, имеющий меньшее значение потенциала в конкретной паре электродов, называется анодом(–), на нем идет процесс окисления, т.е. отдачи электронов. Электрод, имеющий большее значение потенциала, называется катодом(+), на нем протекает процесс восстановления, т.е. приема электронов.
В схеме записи гальванического элемента слева принято записывать анод.
Электродвижущая сила (ЭДС) гальванического элемента – это равновесная разность потенциалов между катодом и анодом, которая всегда положительна по величине.
Пример. Рассмотрим работу и вычислим ЭДС железомедного гальванического элемента Fe / FeSO4 // CuSO4 0,01М / Cu. Вычислим электродные потенциалы и установим роль каждого из электродов.
Поскольку концентрация раствора FeSO4 не указана, то она принимается стандартной, т. е. 1 моль/л. Тогда
jFe2+/Fe = j0Fe2+/Fe = – 0,44 B (см. таблицу стандартных потенциалов на с. 99).
Для расчета электродного потенциала медного электрода воспользуемся уравнением Нернста:
jCu2+/Cu = j0 Cu2+/Cu + 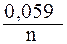 lg [Cu2+] = 0,34 +
lg [Cu2+] = 0,34 + 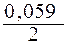 lg 0,01 = 0,34 –
lg 0,01 = 0,34 –
– 0,059 = 0,281 B.
Сравнивая величины электродных потенциалов, выясняем, что медный электрод является катодом, а железный – анодом (jк > jа).
На аноде идет процесс окисления:
А (-): Fe0 – 2ē = Fe2+.
На катоде идет процесс восстановления:
К(+): Cu2+ + 2ē = Cu0.






