· Повышение давления в системе смещает равновесие в направлении реакции, которая идет с уменьшением количества газообразных веществ, т.е. с уменьшением давления.
· Уменьшение давления способствует смещению химического равновесия в сторону реакции, протекающей с увеличением количества газообразных веществ, т.е. с увеличением давления.
Например, в реакции

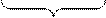 N2(г)+3H2(г)
N2(г)+3H2(г) 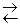 2NH3(г),
2NH3(г),
4 моль 2 моль
увеличение давления приведет к смещению равновесия в сторону прямой реакции. В реакции
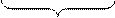
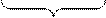 FeO(к)+CO(г)
FeO(к)+CO(г) 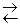 CO2(г)+Fe(к)
CO2(г)+Fe(к)
1 моль 1моль
количества моль газообразных веществ в правой и левой части уравнения реакции одинаковы, реакция протекает без изменения объема, следовательно, изменение давления на равновесие системы не повлияет.
Катализаторы не влияют на смещение равновесия.
Константа равновесия связана с энергией Гиббса следующим соотношением:
DGо = – RT lnKp,
DGо – изменение энергии Гиббса химическойреакции, кДж
R – универсальная газовая постоянная (R = 8,314 Дж/моль K)
T – абсолютная температура, K
Kp – константа равновесия химической реакции
КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Оксиды
Оксиды – сложные вещества, состоящие из кислорода и какого-либо другого химического элемента. Степень окисления кислорода в оксидах равна - 2.
  Оксиды Оксиды
| |||
   Солеобразующие Солеобразующие
| Несолеобразующие | ||
| Кислотные | Амфотерные | Основные | CO, NO, N2O, NO2 |
Кислотные оксиды – это:
1) оксиды неметаллов, которым соответствуют кислоты (например: CO2(H2CO3), SO2(H2SO3), SO3(H2SO4) и др.);
2) оксиды металлов в высокой положительной степени окисления (+ 5, +6, + 7; например, Mn2O7, CrO3, Bi2O5 и др.).
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с водой, образуя кислоты. Исключение составляет SiO2, Bi2O5.
SO3 + H2O = H2SO4
Mn2O7 + H2O = 2HMnO4
2. Взаимодействуют с основными оксидами, образуя соль:
CO2 + CaO = CaCO3
3. Взаимодействуют с основаниями, образуя соль и воду:
SO3 + Ca(OH)2 = CaSO4 + H2O
Основные оксиды – это оксиды металлов (Na2O, CaO, MnO и др.) в низкой степени окисления (+1, +2).
Химические свойства основных оксидов
1. Взаимодействуют с водой только оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов, образуя основания (щелочи):
BaO + H2O = Ba(OH)2
2. Основные оксиды взаимодействуют с кислотными оксидами, образуя соли
SrO + CO2 = SrCO3
3. Взаимодействуют с кислотами, образуя соль и воду:
CuO + 2HCl = CuCl2 + H2O
Амфотерные оксиды – это такие оксиды металлов в степени окисления +2, +3, +4, которые в зависимости от условий могут проявлять и основные, и кислотные свойства (ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Fe2O3, SnO2, PbO2, TiO2, MnO2 и др.)






