Ультрафільтрування полягає у пропусканні розчинів під тиском крізь напівпроникні мембрани. Спеціально виготовлені (наприклад, на основі ацетату целюлози або поліетилентерефалевих плівок) пористі мембрани повинні задовольняти таким вимогам:
- вибірково пропускати одні компоненти суміші, затримуючи інші, тобто мати високу роздільну здатність (селективність);
- мати високу проникність (питому продуктивність);
- мати високу механічну міцність і постійні технічні характеристики;
- не містити токсичних речовин;
- мати порівняно невисоку ціну.
Механізм ультрафільтрування може бути представлений таким чином: пори мембрани достатньо великі для пропускання молекул розчинника, але надто малі для пропускання розчинених речовин.
Ультрафільтрування і зворотній осмос відрізняються від звичайного фільтрування тим, що при їх здійсненні отримують два розчини, один з яких містить більшу кількість розчиненої речовини. В цьому випадку для нормальних умов роботи неприпустиме накопичення осаду на поверхні мембрани.
Зворотним осмосом називають спосіб концентрування даного розчину (включаючи усі компоненти) або спосіб виділення чистого розчинника з розчину, а ультрафільтрування є спосіб концентрування високомолекулярних сполук (з молекулярною масою більшою за 500) з одночасним їх очищенням від низькомолекулярних сполук.
При реалізації ультрафільтрування та зворотнього осмосу необхідно подолати осмотичний тиск π розчину, який розділяється, тому що розчинник переноситься у напрямку, зворотному до збільшення концентрації розчиненого компоненту, що утримується мембраною.
Розглянемо схему зворотного осмосу (рис. 19).
Спонтанний перехід розчинника (води) у розчин, що знаходиться під тиском Р1, крізь напівпроникну мембрану припиняється, як тільки осмотичний тиск досягає тиску Р1 і настає рівновага (Р1dπ). Створення надлишкового тиску Р = π+∆Р приводить до оберненого переходу розчинника (води) з розчину крізь мембрану, тобто до зворотного осмосу.

Рис. 19. Схема зворотного осмосу
Величина осмотичного тиску π (в Па) розчину є прямо пропорційною його температурі і концентрації і обернено пропорційною молекулярній масі розчиненого компоненту:
 (15)
(15)
де і=1+а – коефіцієнт Вант-Гоффа; а – ступінь дисоціації розчиненої речовини; R – універсальна газова стала; Т – температура розчину, К; С - концентрація розчиненої речовини, кг/м3; М – молярна маса розчиненої речовини, кг/моль.
Рівняння (15) називається рівнянням Вант-Гоффа. Воно показує, що величина осмотичного тиску для розчинів різних речовин коливається в дуже широких межах.
Таким чином, при розділенні розчинів низькомолекулярних сполук необхідно подолати значний осмотичний тиск, а при ультрафільтруванні (М ≥500) осмотичний тиск знаходиться у межах 0,3-1 МПа.
Селективність мембрани φ (в %) можна розрахувати за формулою:
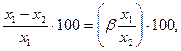 (16)
(16)
де х1 і х2 – масова концентрація розчиненої речовини у вихідній суміші і у фільтраті, %.
Загальна пористість β (в %) мембрани може бути розрахована за формулою:
 (17)
(17)
де ρ – густина матеріалу мембрани, кг/м3; ρ1 – густина мембрани, що визначається зважуванням визначеного її об’єму.
Величина пористості мембрани, а також форма і довжина пор впливають на її проникність.




