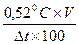Расчет проводят по следующей схеме:
1. Определяют количество натрия хлорида, необходимое для изотонирования выписанного объема раствора, не обращая внимания на то, что часть раствора изотонируется лекарственным веществом, то есть для изотонирования 100 мл раствора необходимо 0,9 г натрия хлорида.
2. Затем, учитывая количество лекарственного вещества, в приведенном примере (оно равно 2,0 г гексаметилентетрамина) находят, какая часть выписанного объема изотонируется лекарственным веществом.
При расчете исходят из определения изотонического эквивалента по натрия хлориду. Зная, что Е гексаметилентетрамина по натрия хлориду равен 0,22, определяют, что 1,0 г гексаметилентетрамина соответствует 0,22 г натрия хлорида, а 2,0 г гексаметилентетрамина, выписанного в рецепте, - 0,44 г натрия хлорида.
3. Далее определяют, какое количество натрия хлорида необходимо добавить для изотонирования 0,9 - 0,44 = 0,46 г натрия хлорида.
Расчет на основании закона Рауля, который гласит, что давление пара над раствором пропорционально молярной доле растворенного вещества:
Dt = К × С, где
Dt - депрессия (понижение температуры замерзания раствора), °С;
С - концентрация вещества, моль/л;
К - криоскопическая константа растворителя.
Следствие из закона Рауля:
ü понижение температуры замерзания (дипрессия) пропорционально понижению давления пара и пропорционально концентрации растворенного вещества в растворе;
ü изотонические растворы различных веществ замерзают при одной и той же температуре, то есть имеют одинаковую температурную дипрессию 0,520С (дипрессия сыворотки крови).
|
1 % - Dt (справочные данные)
х – 0,520С
|
вещества, необходимое для
изотонирования, г;
V – объем, мл
Изотоничность раствора является необходимым, но не единственным требованием, которому должны отвечать плазмозамещающие растворы. Они должны быть изоионичны - содержать необходимый солевой комплекс, воссоздающий состав плазмы крови. Поэтому в состав плазмозамещающих растворов вводят ионы К2+, Са2+, Mg+, Na+, С1-, S042-, Р043- и др.
Основным компонентом физиологического раствора является натрия хлорид-главная составная часть кровяной плазмы. Кроме ионов натрия, физиологический раствор содержит ионы K+, Ca2+, Mg2+. Установлено, что в кровяной плазме ионы натрия, калия, кальция, магния находятся в следующем соотношении:
Na: K: Ca: Mg = 100: 5: 3: 0,6
Растворы должны быть изогидричны, то есть соответствовать значению рН плазмы крови 7,36-7,47. Изогидричные растворы должны обладать способностью сохранения постоянства концентрации водородных ионов. Это требование связано с тем, что в процессе жизнедеятельности клеток и органов образуются кислые продукты обмена, нейтрализация которых осуществляется при помощи буферных систем крови. Изогидричность растворов достигается введением определенных буферных систем, которые и поддерживают на одном уровне концентрацию водородных ионов и не взаимодействуют с находящимися в растворе лекарственными веществами.
Осмоляльность -это показатель, позволяющий оценить суммарный вклад различных растворенных веществ в осмотическое давление раствора (ГФ РБ Т. I, С. 69-71).
Единицей осмоляльности является осмоль на килограмм растворителя (осмоль/кг), но на практике обычно используется единица миллиосмоль на килограмм растворителя (молмоль/кг).
Осмоляльность определяется по понижению температуры замерзания раствора, если нет других указании в частной статье. Зависимость между осмоляльностью и понижением температурой замерзания ΔТ выражают соотношением:

Наряду с понятием «осмоляльность» в практике используют понятие «осмолярность». Аналогично осмоляльности, осмолярность показатель, позволяющий оценить суммарный вклад различных растворенных веществ в осмотическое давление раствора.
Данные показатели близки и отличаются друг от друга только способом выражения концентрации растворов – моляльной и молярной (рис. 76)
Для идеальных растворов масса осмоля в граммах представляет собой отношение грамм-молекулярной массы вещества к числу частиц или ионов, образующихся при его растворении.
Для разбавления растворов, близких к идеальным, осмоляльность и осмолярность могут быть рассчитаны теоретически.
Осмолярность идеальных растворов может быть рассчитана по форму ле:

Рис. 76. Осмолярность, осмоляльность.
Осмолярность = концентрация вещества × количество частиц
Молекулярная масса
где: концентрация вещества – количество растворенного вещества на 1 л раствора, в граммах;
количество частиц – число частиц или ионов образующихся при растворении одно молекулы вещества;
Единицей осмолярности является осмоль на литр раствора (осмоль/л), но на парктике обычно используется единица миллиосмоль на литр раствора (мосмоль/л).
При повышении концентрации раствора взаимодействие между частицами вещества возрастает, и фактическая осмолярность понижается по сравнению с осмолярностью идеального раствора. Теоретически расчет осмолярности растворов веществ с большой молекулярной массой (например, белковых гидролизатов) и высококонцентрированных растворов невозможен. В таких случаях путем по понижению температуры замерзания раствора или по понижению давления пара над раствором. Понижение температуры замерзания на 1,86оС и понижение давления пара на 0,3 мм рт. ст. при температуре 25о соответствует 1 осмолю на килограмм воды.
Растворы, равные по осмоляльности (осмолярности) 0,9% раствору натрия хлорид, называют изотоничными.
Осмолярность плазмы крови здорового человека составляет в среднем 285 мОсм/л, раствора натрия хлорида 0,9% - 302,4, раствора глюкозы 5% - 290, раствора глюкозы 10% - 600 мОсм/л.
Гиперосмолярные состояния наступают в результате почечной недостаточности, острой и хронической сердечной недостаточности, инфаркта миокарда, ожогов, сепсиса и приводят к гибели от 4 до 70% больных.
Введение в организм инфузионных растворов без учета их осмолярности и ионного состава, например, больших доз маннитола или натрия гидрокарбоната, может привести к развитию тромбозов, кровотечений, вызвать тяжелые повреждения внутренних органов. Так 8,4% раствор натрия гидрокарбоната на 20% растворе глюкозы, применяющийся для коррекции ацидоза у новорожденных детей, часто вызывает гиперосмолярную кому.
Некоторые плазмозамещающим растворы промышленного производства отвечают требованиям изоионичности, изогидричности, изовязкостности, которые не являются фармакопейными.
Изовязкостность -Многие инфузионные растворы имеют серьезный недостаток – они быстро выводятся из организма из-за отсутствия необходимой вязкости.
Кровяная плазма обладает определенной вязкостью (1,5-1,65 сП) за счет присутствия в ней белков.
Для повышения вязкости к растворам добавляют высокомолекулярные соединения. Они очень мало изменяют осмотическое давление и, так как не переходят в мочу, задерживают выделение воды и растворенных в ней солей. Наиболее часто с этой целью применяют декстран – полимер глюкозы и поливинилпирролидон.
Плазмозамещающие растворы - растворы близкие по осмотическому давлению, ионному составу, вязкости и значению рН к кровяной плазме, способные поддерживать жизнедеятельность клеток и органов и не вызывающие существенных сдвигов физиологического равновесия в организме.
Физиологическимирастворами называются такие растворы, которые по своему осмотическому давлению, ионному составу и значению рН близки к кровяной плазме. Во многие физиологические растворы для создания окислительно-восстановительного потенциала и для питания клеток вводят глюкозу, содержание которой в крови в норме бывает 8-12 мг %.
В некоторых случаях требуется, чтобы вязкость раствора соответствовала вязкости кровяной плазмы (1,5-1,65 сантипуаз). Это достигается путем введения ВМС.
Физиологические растворы (солевые) относятся к группе кристаллоидных плазмозамещающих растворов.
Задачи инфузионной терапии:
ü поддержание нормального объема и состава внеклеточной жидкости, в том числе и объема циркулирующей крови;
ü нормализация электролитного баланса организма с учетом естественной потребности в электролитах и их патологических потерь;
ü коррекция сдвигов кислотно-щелочного состояния
ü нормализация гомеостатических и реологических с крови;
ü поддержание нормальной макро- и микроциркуляи
ü профилактика и лечение нарушений функции сердца, легких, печени, почек, ЖКТ, эндокринных желез;
ü обеспечение адекватного метаболизма, то есть возмещение энергетических затрат организма и коррекции белкового, липидного и углеводного обменов.
Плазмозамещающие растворы классифицируются по:
1. виду лекарственной формы (растворы для внутривенных инфузий, эмульсии, концентраты для внутривенных инфузий, порошки и лиофилизированные лекарственные формы для внутривенных инфузий, инфузионные лекарственные средства, приготовленные методом замораживания);
2. функциональному назначению(рис 77);
3. составу и особенностям применения (рис. 78).
К плазмозамещающим жидкостям предъявляются следующие требования:
1. Стерильность.
2. Апирогенность. Лечебная эффективность раствора должна обеспечивать сохранение жизни человека и быстрое выздоровление после смертельной кровопотери.
3. Раствор не должен оказывать какого-либо отрицательного действия на организм, обнаруживаемого или непосредственно после введения или через некоторое время.
4. Лечебная эффективность раствора должна обеспечивать сохранение жизни человека и быстрое выздоровление после смертельной кровопотери.
5. Раствор должен сохраняться длительное время и не требовать особых условий для его транспортировки.
6. Молекулярная масса коллоидного раствора должна быть в среднем в пределах 500 00-100 000, то есть примерно соответствовать молекулярному весу альбумина (69000), что обеспечивает необходимое коллоидно-осмотическое давление раствора.
Известно, что растворы с молекулярным весом ниже 30 000 быстро исчезают из кровяного русла, выделяясь с мочой. В то же время растворы с высоким молекулярным весом (выше 100 000) резко поднимают коллоидно-осмотическое давление, увеличивают вязкость и, долго задерживаясь в организме, могут оказывать вредное влияние.
7. Полноценный плазмозамещающий раствор не должен:
а) понижать свертываемость крови;
б) вызывать агглютинацию эритроцитов;
в) ускорять РОЭ.
8. Плазмозамещающие жидкости, кроме отсутствия токсических антигенных и пирогенных свойств, должны достаточное время задерживаться в кровеносном русле и поддерживать массу циркулирующей крови после введения их в кровь.
9. Составные части раствора должны усваиваться организмом, то есть. включаться в соответствующие виды обмена веществ (табл. 39).
Считается, что если 50 % плазмозамещающего раствора останется в организме через 12 ч после его введения, то хороший эффект будет обеспечен, так как через этот срок уже могут быть активизированы собственные приспособительные силы организма.
Противошоковые жидкости - это такие плазмозамещающие жидкости, в которые помимо обычных компонентов входят и некоторые лекарственные вещества (алкоголь, бромиды, наркотики).


Рис. 77. Классификация плазмозамещающих растворов по функциональному
назначению

Рис. 78. Классификация плазмозамещающих растворов по составу и особенностям применения
Противошоковые жидкости можно разделить на 3 группы:
1. Простые противошоковые жидкости, содержащие соли, глюкозу, алкоголь.
2. Сложные противошоковые растворы, содержащие глюкозу, алкоголь, бромиды, наркотики.
3. Сложные противошоковые растворы, содержащие глюкозу, алкоголь, бромиды, наркотики и плазму крови.
Таблица 39. Физиологические постоянные плазмы крови человека.
| Осмотическое давление, Па | 72,52×104 |
| Ионный состав | Катионы: К+, Na+, Са2+, Mg2+ Анионы: Сl-, S042-, НР032- НСO3-, PO43- |
| Значение рН | 7,36-7,47 (применяют: карбонатную, фосфатную и белковую системы амфолитов) |
| Вязкость, Нхс/м2(сП) | 0,0015 - 0,0016 (1,5 - 1,6) |
| Осмолярность, мосмоль/л | около 300 (соответствует давлению около 780 кПа) |
Сложные солевые растворы имеют следующие составы:
| Трисоль Rp. Natrii chloridi 5,0 Kalii chloridi 1,0 Natrii hydrocarbonatis 4,0 Aq. pro injectionibus ad 1000,0 M. Sterilisetur! | Дисоль Rp.: Natrii chloridi 6,0 Natrii acetatis 2,0 Aq. pro inject ad 1000,0 М. Sterilisetur! |
| Хлосоль Rp.: Natrii chloridi 4,75 Kalii chloridi 1,5 Natrii acetatis 3,6 Aq. pro inject. ad 1000,0 M. Sterilisetur! | Ацесоль Rp.: Natrii chloridi 5,0 Kalii chloridi 1,0 Natrii acetatis 2,0 Aq. pro inject. ad 1000,0 M. Sterilisetur! |
| Квартасоль Rp.: Natrii chloridi 4,75 Kalii chloridi 1,5 Natrii hydrocarbonatis 1,0 Natrii acetatis 2,6 Aq. pro injectionibus ad 1000,0 M. Sterilisetur! | Раствор Рингера Rp.: Natrii chloridi 9,0 Kalii chloridi 0,2 Natrii hydrocarbonatis 0,2 Calcii chloridi hexahydratis 0,2 Aq. pro injectionibus ad 1000,0 M. Sterilisetur! |
| Жидкость Петрова кровозамещающая Rp.: Natrii chloride15 Kalii chloridi 0,2 Calcii chloridi hexahydratis 1,0 Aq. pro injectionibus ad 1000,0 M. Sterilisetur! |
Приготовление растворов заключается в последовательном растворении всех входящих в их состав солей в воде для инъекций. Натрия гидрокарбонат, входящий в состав некоторых из них, добавляют после растворения всех солей. Растворение необходимо производить в плотно закрытых сосудах, избегая сильного взбалтывания, чтобы предотвратить потерю углекислоты. Передают на анализ провизору-аналитику. Растворы фильтруют в стерильные флаконы из химически-устойчивого стекла вместимостью 450 мл и укупоривают стерильными резиновыми пробками. Флаконы просматривают на отсутствие механических включений, обкатывают металлическими колпачками и стерилизуют паром под давлением (давл. 0,1 МПа, t=1200С, в течение 12 мин.). На этикетки с инфузионными растворами обязательно указание их осмоляльности (осмолярности). Срок хранения растворов 1 месяц.
Применяют солевые растворы для лечения ряда инфекционных заболеваний (холера, дизентерия, пищевые токсикоинфекции), для ликвидации вызванных ими последствий.
Таблица 40. Кардиоплегические растворы №1, №2, №3.
| Наименование веществ | Количество (г) | ||
| Раствор №1 | Раствор №2 | Раствор №3 | |
| Магния сульфат гептагидрат (MgSO4×7H2O; М.м. 246,50 | 1,92 | 1,92 | 1,92 |
| Натрия хлорид (NaCl; М.м. 58,44) | 7,66 | 7,66 | 7,66 |
| Калия хлорид (KCl; М.м. 74,56) | 8,0 | 4,5 | 8,0 |
| Глюкоза безводная (C6Н12О6; М.м. 180,2) | 14,5 | 8,0 | 8,0 |
| Кальция хлорида 50% раствор | 0,44мл | 0,44 мл | 0,44мл |
| Ода для инъекций | до 1000 мл | до 1000 мл | до 1000 мл |
Раствор Рингера-Локка
Rp: Natrii chloridi 9,0
Kalii chloridi 0,2





 %
%