Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пи-римидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.



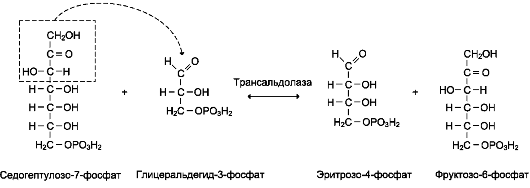

Роль: Реакции окислительного этапа служат основным источником NADPH в клетках.
энергетическое - метаболиты окислительной части исп.в гликолизе; 2) синтетическое - связано с использованием рибозо-5-фосфата и НАДФН. Рибозо-5-фосфат используется на синтез нуклеотидов, которые необходимы для образования коферментов, макроэргов, нуклеиновых кислот. НАДФН необходим для восстановительныхбиосинтезов; для работы гидроксилаз, участвующих в синтезе катехоламинов,;
Регуляция ПФП: ключевыми ферментами - глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа, транскетолаза. Активность ПФП увеличивается при повышении отношения НАДФ+/ НАДФН, а также под влиянием инсулина и йодтиронинов. ПФП ингибируют глюкокортикостероиды.
ПФП мало активен в нервной, мышечной и соединительной тканях. ПФП способствует прозрачности хрусталика глаза; предупреждает гемолиз эритроцитов; входит в систему защиты от свободных радикалов и активных форм кислорода.
| 20. | Глюкоза крови: источники, регуляция гормонами. Гипо- и гипергликемия, причины. Сахарные нагрузки и сахарные кривые, значение в диагностике. |
Концентрация глюкозы в крови поддерживается на постоянном уровне 3,3 - 5,5 ммоль/л. Он обеспечивается двумя противоположно направленными процессами:
1. поставляющими глюкозу в кровь (переваривание углеводов в ЖКТ, ГНГ, распад гликогена печени) и
2. использующими глюкозу в тканях (гликолиз, синтез гликогена, ПФП, синтез жира).
При очень высокой концентрации глюкозы в крови (> 9 – 10 ммоль/л), она может быть снижена за счет выведения ее с мочой. Такое явление называют глюкозурией. В норме концентрация глюкозы в моче составляет 0,2 - 1,2 ммоль/л.
Регуляция: Нервная регуляция концентрации глюкозы в крови выражается в положительном влиянии n.vagus на секрецию инсулина и тормозящем влиянии на этот процесс симпатической иннервации. Кроме этого, выделение адреналина в кровь подвержено симпатическим влияниям.
Основными факторами гормональной регуляции являются глюкагон, адреналин, глюкокортикоиды, соматотропный гормон с одной стороны, и инсулин с другой.
Многие ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты.
Глюкагон повышает содержание глюкозы крови:
-увеличивая мобилизацию гликогена через активацию гликогенфосфорилазы,
-стимулируя глюконеогенез
Адреналинвызывает гипергликемию:
-активируя мобилизацию гликогена
Глюкокортикоиды повышают глюкозу
-за счет подавления перехода глюкозы в клетку,
-стимулируя глюконеогенез
Причины гипергликемии:1) алиментарная (пищевая); 2) сахарный диабет (возникает при недостатке инсулина); 3) патология ЦНС (менингит, энцефалит); 4) стресс; 5) избыток гипергликемических гормонов; 6) повреждение поджелудочной железы. Длительная гипергликемия приводит к истощению запасов инсулина, потере воды тканями, поступлению ее в кровь, увеличению кровяного давления, увеличению диуреза. Гипергликемия в 50-60 ммоль/л может привести к гиперосмолярной коме.
Длительная гипергликемия приводит к неферментативному гликозилированию белков плазмы крови, почечных канальцев, нейронов, изменяет их свойства, что является причиной тяжелых осложнений: тканевых гипоксий, катаракты, почечной недостаточности,
Гипогликемия - это снижение концентрации глюкозы в крови.
Причины гипогликемии: 1) пищевая; 2) при тяжелой мышечной работе; 3) воспалительные процессы жкт); 4) патология печени; 5) патология ЦНС; Гипогликемияприводит к гипогликемической коме.
Сахарные нагрузки и сахарные кривыеиспользуют для диагностики сахарного диабета. Обследуемому даётся р-р глюкозы из расчета 1гм на 1кг массы тела. Концентрацию глюкозы измеряют сначала на тощак, а потом в течении 2-3х часов с интервалом в 1ч. По результатам строятся сахарные кривые.
| 21. | Функции липидов. Пищевые жиры; норма суточного потребления, переваривание, всасывание продуктов переваривания. Ресинтез жиров в клетках кишечника. Хиломикроны, строение, значение, метаболизм. Пределы изменения концентрации жиров в крови. |
Пределы конц жиров в крови:Норма-4-8г/л, если больше-гиперлипемия(при сах диабете, ожирении). В норме концентрация жиров в крови колеблется в довольно широких пределах — 10-200 мг/дл, в среднем около 0,1 %.
Липиды – органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
Функции:
1. Резервно-энергетическая функция. 9,3 кКал Е. Является резервом эндогенной воды 1,7г воды
2. Структурная функция. Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол.
3. Сигнальная функция. Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками.
4. Защитная функция. жир
5. Необходимы для растворения и всасывая жирорастворимых витаминов (А, Е, D,K,Q)
6. Являются предшественниками других соединений: глицерин испол-ся на синтез глюкозы, жирные к-ты окисляются до ацетилКоА и могут быть использованы на образование ацетилхолина)
7. Специфические функции: обеспечивают устойчивость эритроцитов, ганглиозиды связывают различные токсины и яды.
80-100 г в сутки жира должно быть
Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием «липазы языка».
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу. используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к воде
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ. Переваривание жиров - гидролиз жиров панкреатической липазой и колипазой.
рн8
3. Образование мицелл В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие мицеллы. Свободный глицерол всасывается прямо в кровь.
4. Всасывание мицелл.. всасываются. 1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь просто.Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Через водную фазу мицеллы мигрируют к каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты проникают внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирных кислот: HS КоА + RCOOH + АТФ → R-CO ~ KoA +АМФ + Н4Р2О7. Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой).
 ацилтрансфе-раза
ацилтрансфе-раза
2. В клетках слизистой оболочки тонкой кишки всосавшиеся молекулы холестерола также превращаются в эфиры путём взаимодействия с ацил-КоА (рис. 8-17). Эту реакцию катализирует ацил-холестерол-ацил-трансфераза (АХАТ)

В клетках эпителия тонкой кишки из жиров, формируются липопротеиновые комплексы - хиломикроны ХМ далее доставляют жиры в периферические ткани.
Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов - фосфолипидами и холестеролом.
ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани,.
хм большие поэтому идут в лимфу, затем через грудной проток в кровь.
В крови триацилглицеролы, входящие в состав зрелых ХМ, гидролизуются ферментом липопротеин-липазой находящимся на поверхности эндотелиаль-ных клеток, В результате действия ЛП-липа-зы на жиры ХМ образуются жирные кислоты и глицерол.
жирные кислоты в ткани
глицерол в печень
остаточные хиломикроны попадают в гепатоциты посредством эндоцитоза и разрушаются.
| 22. | Окисление глицерина и высших жирных кислот. Последовательность реакций. Связь β-окисления с циклом Кребса и дыхательной цепью. Физиологическое значение окисления жирных кислот в зависимости от ритма питания и мышечной активности. |
Этапы окисления жирных кислот: 1. активироваться в цитозоле.
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + PPi.
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану,и он заходит в комплексе с карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
3. После св-ия с карнитином ж к-та переносится ч/з мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь обр-ет ацил-S-КоА вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. 
образовавшийся фадН2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ
Восстановленный NADH,окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ
Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA →
8 CH3-CO-KoA + 7 FADH2 + 7 (NADH + H+).131-2 на активацию жк=129атф
Глицерин – трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень. Окисление глицерина
 Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты.
Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты.
Е значение в-окисление имеет для скелетных мышц (50% Е), для сердечной мышцы (70%), головной мозг и другие нервные ткани, а также эритроциты не используют жирные к-ты для окисления; они не поступают в головной мозг, т.к. не проходят ч/з гематоэнцефалический барьер.






