Каждая из систем репарации включает следующие компоненты:
· ДНК-хеликаза — фермент, «узнающий» химически изменённые участки в цепи и осуществляющий разрыв цепи вблизи от повреждения;
· экзонуклеаза — фермент, удаляющий повреждённый участок;
· ДНК-полимераза — фермент, синтезирующий соответствующий участок цепи ДНК взамен удалённого;
· ДНК-лигаза — фермент, замыкающий последнюю связь в полимерной цепи и тем самым восстанавливающий её непрерывность.
| 39. | Типы РНК: особенности строения, размеры и разнообразие молекул, локализация в клетке, функции. Биосинтез РНК (транскрипция). Строение рибосом и полирибосом. Синтез аминоацил-тРНК. Субстратная специфичность аминоацил-тРНК-синтетаз. |
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи.
Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C.
Третичная структура РНК. Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры.Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями.
(мРНК, синоним — информацио́нная РНК, иРНК) — РНК, содержащая информацию о первичной структуре (аминокислотной последовательности) белков[1]. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходетрансляции как матрица для синтеза белков. Длина типичной зрелой мРНК составляет от нескольких сотен до нескольких тысяч нуклеотидов
Зрелая мРНК состоит из нескольких участков, различающихся по функциям: «5'-кэп»шапочка для узнаваня и защиты от5нуклеаз.,
5'-нетранслируемая область Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область,, регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции.
кодирующая (транслируемая) область,
3'-нетранслируемая область и
3'-полиадениновый «хвост». последовательность адениновых оснований
Примерами вторичной структуры могут служить стебель-петля и псевдоузел
тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к местусинтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм.
тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». Аминокислота ковалентно присоединяется к 3'-концу молекулы с помощью специфичного для каждого типа тРНК ферментааминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий аминокислоте.
(рРНК) — несколько молекул РНК, составляющих основу рибосомы. Основной функцией рРНК является осуществление процесса трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образования пептидных связеймежду присоединёнными к тРНК аминокислотами. Рибосомальные РНК (рРНК). Рибосомальные РНК имеют многочисленные спирализованные участки. Различают рРНК - 5S, 5,8S, 28S и 18S (S - коэффициент седиментации). Рибосомальные РНК содержат несколько модифицированных нуклеотидов, чаще всего это метилированные производные азотистых оснований или рибозы (2'-метилрибоза). рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
в транскрипции выделяют 5 необходимых элементов:
1)матрица – одна из цепей ДНК,
2)растущая цепь – РНК,
3)субстрат для синтеза – рибонуклеотиды (УТФ, ГТФ, ЦТФ, АТФ),
4)источник энергии – УТФ, ГТФ, ЦТФ, АТФ.
5)ферменты РНК-полимеразы и белковые факторы транскрипции.
Стадии транскрипции. Выделяют три стадии транскрипции: инициация, элонгация и терминация.
Инициация. Промотор содержит стартовый сигнал транскрипции – ТАТА-бокс. Он связывает 1 факторинициации тата-фактор.Этот ТАТА-фактор обеспечивает присоединение РНК-. Для связывания РНК-полимеразы с промотором необходим– σ-фактор, но сразу после синтеза затравочного фрагмента РНК (длиной 8-10 рибонуклеотидов) σ-фактор отрывается от фермента.Другие факторы инициации раскручивают спираль ДНК перед РНК-полимеразой.
Элонгация. Белковые факторы элонгации обеспечивают продвижение РНК-полимеразы вдоль ДНК и расплетают молекулу. РНК-полимераза продвигается в направлении 5'→3'. Фермент использует АТФ, ГТФ, ЦТФ, УТФ одновременно в качестве субстрата и в качестве источника энергии.
Терминация. РНК-полимераза остановится, когда достигнет терминирующих кодонов. С помощью белкового фактора терминации, так называемого ρ-фактора (греч. ρ – "ро"), от матрицы ДНК отделяются фермент и синтезированная молекула РНК, которая является первичным транскриптом, предшественником мРНК или тРНК или рРНК.
Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг. РНК включают в себя информативные (экзоны) и неинформативные (интроны) участки.
1. Сплайсинг – особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов.
Состоят из двух разделяемых субчастиц, или рибосомных субъединиц. При определенных условиях Р. обратимо диссоциирует на две субчастицы с соотношением их мол. масс ок. 2:1. Эукариотическая Р. разделяется на субчастицы 60S и 40S. Две рибосомные субчастицы объединены в полную Р. строго определенным образом, предполагающим специфич. контакты их поверхностей. Полисома - Временный комплекс (4-5 и более) рибосом, транслирующих одновременно одну молекулу мРНК.
Каждой трнк соответсвует своя аминокислота и за связывание эфирной связью отвечает свя аминоацил-трнк-синтетаза
Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК
| 40. | Биологический код. Основные компоненты белоксинтезирующей системы. Биосинтез белка. Механизм. Адапторная функция тРНК и роль мРНК в этом процессе. |
Генетический (биологический) код – это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырехзначного языка нуклеотидов (А, Г, У, Ц) в двадцатизначный язык аминокислот. Он обладает характерными особенностями:
Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота.
Вырожденность – одной аминокислоте может соответствовать несколько кодонов.
Универсальность – биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения).
Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.
Однонаправленность – при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад.
адапторная роль тРНК заключается:
1.в специфичном связывании с аминокислотами,
2.в специфичном, согласно кодон-антикодоновому взаимодействию, связывании с мРНК,
3.и, как результат, во вкл Трансляция – это биосинтез белка на матрице мРНК.
ючении аминокислот в белковую цепь в соответствии с информацией мРНК.\
основные компоннты белоксинтез системы
- Аминокислоты
Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве.
- Аминоацил-тРНК синтетазы
-Рибосомы В 40S субъединицу входит рРНК с константой седиментации 18S и 33 молекулы белков. В 60S субъединице обнаружено 3 вида рРНК: 5S, 5,8S и 28S и 49 различных белков.
- Белковые факторы Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины.
Инициация. Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса: первый комплекс – мРНК + малая субъединица + ИФ-3,
второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы
После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК
Первый цикл (и следующие циклы) элонгации включает три шага: 1.Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
Терминация. Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
1)Гидролитическое отщепление полипептида от конечной тРНК.
2)Отделение от П-центра последней, уже пустой, тРНК.
3)Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
Далее процессинг
1. Удаление с N-конца метионина
2. Образование дисульфидных мостиков между остатками цистеина.
3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ.
4. Присоединение химической группы к аминокислотным остаткам белковой цепи: фосфорной кислоты карбокси группы метильной гидроксильной
5. Включение простетической группы:
Гемма углеводных остатков
Фолдинг белков – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру.
| 41. | Регуляция биосинтеза белка. Индукция и репрессия синтеза белка на примере функционирования лактозного оперона кишечной палочки. Ингибиторы матричных биосинтезов: лекарственные препараты, вирусные и бактериальные токсины. |
Предложены две схемы регуляции скорости транскрипции: по механизму индукции (лактозный оперон) и по механизму репресии (триптофановый оперон). Лактозный оперон в целом отвечает за катаболизм лактозы. При изучении E.coli было замечено, что в клетке может быть две взаимоисключающие ситуации:
-активность одного из ферментов катаболизма лактозы низка, если в среде имеется глюкоза.
-активность этого фермента резко повышается в обратной ситуации, т.е. при отсутствии глюкозы и при наличии лактозы.На основании наблюдений была предложена схема регуляции оперона по механизму индукции:
1. В отсутствие лактозы активный белок-репрессор связывается с оператором и блокирует синтез мРНК, кодирующей ферменты катаболизма лактозы. В результате эти ферменты не образуются.
2. Если глюкозы нет, а лактоза есть, то последняя связывается с белком-репрессором и ингибирует его, не давая связаться с геном-оператором. Это позволяет РНК-полимеразе считывать информацию, отвечающую за синтез ферментов катаболизма лактозы, и синтезировать мРНК. Т.о., лактоза является индуктором транскрипции.
Триптофановый оперон в целом отвечает за синтез триптофана.Функционирование триптофанового оперона в некотором смысле противоположно лактозному. Регуляция осуществляется по механизму репрессии.
1. В отличие от лактозного оперона, белок-репрессор синтезируется в неактивном состоянии и не может заблокировать транскрипцию генов, кодирующих ферменты синтеза триптофана. Синтез этой аминокислоты будет в клетке продолжаться до тех пор, пока в питательной среде не появится триптофан.
2. Триптофан соединяется с белком-репрессором и активирует его. Далее такой активный комплекс присоединяется к гену-оператору и блокирует транскрипцию. В этом случае триптофан является репрессором транскрипции.
Регуляция у эукариот
1. Амплификация – это увеличение количества генов, точнее многократное копирование одного гена. Естественно, все полученные копии равнозначны и одинаково активно обеспечивают транскрипцию.
2. Энхансеры – это участки ДНК в 10-20 пар оснований, способные значительно усиливать экспрессию генов той же ДНК. В
3. Сайленсеры – участки ДНК, в принципе схожие с энхансерами, но они способны замедлять транскрипцию генов, связываясь с регуляторными белками (которые ее активируют).
5. Процессинг мРНК – некоторые пре-мРНК подвергаются разным вариантам сплайсинга
в результате чего образуются разные мРНК, и соответственно, белки с разной функцией.
6. Изменение стабильности мРНК – чем выше продолжительность жизни мРНК в цитозоле клетки, тем больше синтезируется соответствующего белка.
Лекарственная регуляция транскрипции
Ингибирование. 1. доксорубицин, дауномицин и актиномицин встраиваться между соседними парами оснований Г-Ц. В результате возникает препятствие для движения РНК-полимеразы остановка транскрипции..
3. α-Аманитин, октапептид бледной поганки (Amanita phalloides) блокирует РНК-полимеразу II эукариот и предотвращает продукцию мРНК.
Многие вещества обладают способностью связываться с элементами рибосом или другими факторами трансляции. Некоторые из этих веществ используются в качестве лекарственных средств, которые в состоянии действовать на разных уровнях трансляции, например:
интерферон активирует внутриклеточные протеинкиназы, которые, в свою очередь, фосфорилируют белковый фактор инициации ИФ-2 и подавляют его активность.
стрептомицин присоединяется к малой субъединице и вызывает ошибку считывания первого основания кодона.
тетрациклины блокируют А-центр рибосомы и лишают ее способности связываться с аминоацил-тРНК,
левомицетин связывается с 50S-частицей рибосомы и ингибирует пептидил-трансферазу,
| 42. | Гемоглобин. Строение. Синтез и распад гемоглобина. Формы билирубина. Пути выведения билирубина и других желчных пигментов. Желтухи. |
Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. 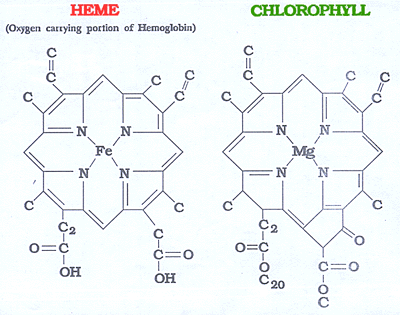
Синтез белковой части (глобина) происходит обычным путем на рибосомах. Для образования гема требуются: железо, глицин, сукцинил-КоА, витамины В6, В12 и фолиевая кислота.
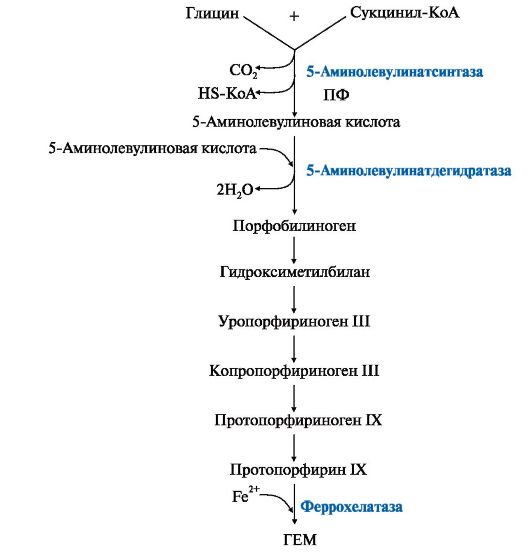

Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина
Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани. Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы
, в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой
Далее попадает по желчным протоам в к иечник где блягодаря микрофлоре превращается в мезоилирубин и мезобилиноген(уробилиноген, часть уробилиногена всасывается и попадает обратно в печень а часть окисляется до стеркобилиногена и окрашивает кал
Различают:
· гемолитическую (или надпеченочную) желтуху,при массивном распаде эритроцитов,переливание несовместимой крови..)высокий уровень свободного илирубина потому что печень не справляется,моча-оранжевая кал черный
· паренхиматозную (или печеночную) желтуху, вирусы токсич соед. Увеличение в крови связанного и свободного илирубина,кал слабо окрашен(мало стеркобилина) моча крепкозаваренный чай
· обтурационную (механическую желтуху).при нарушении оттока желчи в кишечник(жк болезнь. Из за переполнения желчных путей много связанного билируина кал белый моча-чай крепкий
Кроме того, выделяют физиологическую желтуху новорожденных и гемолитическую болезнь новорожденных. Недостаток глюкуронилтрансферазы и повышенное содержание свобоного билирубина нужен фенобарбитал.
| 43. | Белковые фракции плазмы крови. Функции белков плазмы крови. Гипо- и гиперпротеинемия, причины этих состояний. Индивидуальные белки плазмы крови: транспортные белки, белки острой фазы. |
Белки плазмы крови
Белки являются важной составной частью крови и выполняют следующие функции:
1) определяют онкотическое давление;
2) обеспечивают вязкость крови;
3) обеспечивают свертываемость крови;
4) участвуют в регуляции кислотно-основного равновесия;
5) выполняют транспортную функцию (переносят липиды, НЭЖК, металлы, билирубин, гемоглобин, гормоны, лекарственные вещества);
6) обеспечивают иммунитет (антитела, интерферон и др.);
7) питательная функция (белки являются резервом аминокислот).
Белки плазмы обычно делят на альбумины, глобулины и фибриноген.
Альбумины
Это простые, высокогидрофильные белки. Образуются в гепатоцитах печени. Выполняют следующие функции:
– играют важную роль в поддержании коллоидно-осмотического давления крови);
– транспортируют многие вещества, в том числе билирубин, катионы металлов и красок, НЭЖК, холестерин и др.;
– служат богатым и быстро реализуемым резервом аминокислот.
Глобулины
разделены электрофоретически на подгруппы. a и b-глобулины вырабатываются в ретикулоэндотелиальной системе, в том числе купферовскими клетками печени.
a-глобулины состоят из глико- и липопротеидов. a- глобулины участвуют в транспорте различных веществ. Они имеют самую высокую электрофоре-тическую подвижность.
b-глобулины состоят из глико-, липо- и металлопротеидов. Они выполняют транспортную и другие функции.
g-глобулины с самой низкой электрофоретической подвижностью. К этой группе относятся большинство защитных веществ крови, многие из которых обладают ферментативной активностью. g-глобулины синтезируются плазматическими клетками.
Белки - ферменты
1. Собственные ферменты плазмы крови, которые участвуют в свертывании крови, растворении внутрисосудистых сгустков и т.д. Эти ферменты синтезируются в печени.
2. Клеточные ферменты освобождаются из клеток крови и клеток других тканей в результате естественного распада (лизиса). при гепатите - активность аланинаминотрансферазы, аргиназы, аспартат-сердце
Белки - переносчики.
Трансферрин является b-глобулином. Может взаимодействовать с Сu2+ и Zn2+ , но главным образом связывает и переносит Fe3+ в различные ткани.
Гаптоглобин является a2-глобулином, выполняет следующие функции:
– связывает гемоглобин в соотношении 1:1, в результате образуются высокомолекулярные комплексы, которые не могут выводиться почками транспортирует витамин В12;
– является естественным ингибитором катепсина В.
Церулоплазмин является a2-глобулином, выполняет следующие функции:
- является переносчиком и регулятором концентрации ионов меди в организме,
Белки острой фазы
Это группа белков плазмы, содержание которых увеличивается в ответ на повреждение ткани, воспаление, опухолевый процесс. Эти белки синтезируются в печени и являются гликопротеинами. К белкам острой фазы относятся:
– гаптоглобин ( увеличивается в 2-3 раза, особенно при раке, ожогах, хирургических вмешательствах, воспалении);
– церулоплазмин (имеет значение как антиоксидант);
– трансферрин (содержание снижается);
– С-реактивный белок. Отсутствует в сыворотке здорового человека, но обнаруживается при патологических состояниях, сопровождающихся некрозом
– интерферон - специфический белок, появляющийся в клетках в результате проникновения в них вирусов. Он угнетает размножение вирусов в клетках.
– фибриноген, основная функция которого участие в свертывании крови.
Гиперпротеинемия – увеличение общего содержания белков плазмы.рвата диарея, потеря воды организмом, а следовательно, и плазмой приводит к повышению концентрации белка в крови (относительная гиперпротеинемия). При ряде патологических состояний может наблюдаться абсолютная гиперпротеинемия, обусловленная увеличением уровня γ-глобулинов: например, гиперпротеинемия в результате инфекционного или токсического раздражения системы макрофагов;
Гипопротеинемия, или уменьшение общего кол-ва белка в плазме крови, наблюдается гл образом при снижении уровня альбуминов.. Содержание общего белка снижается до 30–40 г/л. Гипопротеинемия наблюдается при поражении печеночных кл (острая атрофия печени, токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.).
| 44. | Остаточный азот крови. Гиперазотемия, ее причины. Уремия. |
остаточный азот крови (сумма всех азотсодержащих веществ крови после удаления из неё белков = Небелковый азот крови). Нормальное содержание 14,3 – 28,6 ммоль/
1) мочевина (примерно 50% 2) АКты (около 25%), 3) креатин и креатинин (7,5%; 4 ) полипептиды, нуклеотиды и азотистые основания (5%;
5) мочевая кислота (4%; 6) аммиак и индикан (0,5%; Индикан представляет собой калиевую или натриевую соль индоксилсерной кислоты, образующейся в печени при обезвреживании индола
Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов Она в свою очередь может быть почечной и внепочечной. При почечной ретенционной азотемии концентрация остаточного азота в крови увеличивается вследствие ослабления очистительной функции почек. 90%мочевины вместо 50%Внепочечные в свою очередь подразделяются на надпочечные и подпочечные
Продукционная азотемия развивается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков при обширных воспалениях, ранениях, ожогах, кахексии и др. Нередко наблюдаются азотемии смешанного типа.
Уреми́я — острое или хроническое самоотравление организма, обусловленное почечной недостаточностью; накопление в крови главным образом токсических продуктов азотистого обмена (азотемия), нарушения кислотно-щелочного и осмотического равновесия.
Проявления: вялость, головная боль, рвота, диарея, кожный зуд, судороги, кома и др.
| 45. | Основные биохимические функции и особенности печени. |
Гепатоцит имеет хорошо развитую систему эндоплазматического ретикулума ЭР как гладкую, так и шероховатую. Функции ЭР - синтез белков, (альбумины), или ферментов работающих в печени. синтезируются фосфолипиды, триглицериды и холестерол
Функции печени: 1. Пищеварительная –Она образует желчь, включающую воду (82%), желчные кислоты (12%), фосфатидилхолин (4%), холестерол (0,7%), прямой билирубин, белки.Желчь обеспечивает эмульгирование и переваривание жиров пищи, стимулирует перистальтику кишечника.
2. Экскреторная функция, близка к пищеварительной – с помощью желчи выводятся билирубин, немного креатинина и мочевины,, холестерол.(в составе желчи)
3. Секреторная – печень синтез альбумина, белков свертывающей системы, липопротеинов, глюкозы, кетоновых тел, креатина.
4. Депонирующая депо гликогена, мин. в-в, особенно железо, витамины A, D, K, B12 и фолиевая кислота.
5. Метаболическая функция – поддержание метаболического гомеостаза
* Углеводный обмен.. Благодаря синтезу и распаду гликогена печень поддерживает конц-ию глюкозы в крови. Гликогена в печени30-100гр.при длительном голодании источником глюкозы яв-ся глюконеогенез из АК и глицерин. превращение гексоз (фруктозы, галактозы) в глюкозу. р-ии ПФ пути обеспечивают синтез НАДФН, необх-го для синтеза ж к-т и холестерола из глюкозы.
* Липидный обмен. Если поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды – холестерол и триацилглицеролы. их удаление происходит при помощи ЛПОНП.. При сильном голодании синтезируются кетоновые тела которые яв-ся альтер. ист. Е
* Белковый обмен. За 7 суток обновляются белки печени– альбумины, многие глобулины, ферменты крови, фибриноген и факторы свертывания крови. АК подвергаются реакциям с трансаминированием и дезаминированием, декарбоксилированию с образованием биогенных аминов. идет утилизация избыточного N и включение его в состав мочевины.
* Пигментный обмен. Участие превращении гидрофобного билирубина в гидрофильную форму и секреция его в желчь
6. Обезвреживающая функция - биотрансформации подвергаются: а) стероидные и тиреоидные гормоны, инсулин, адреналин, б) продукты распада гемопротеинов (билирубин), в) продукты жизнед-ти микрофлоры, всасывающихся из толстого кишечника – кадаверин (производное лизина), путресцин (производное аргинина), крезол и фенол (производное фенилаланина и тирозина) и других токсинов, г)ксенобиотики (токсины, лекарственные вещества и их метаболиты).
| 46. | Взаимосвязь обмена жиров, углеводов и белков. |
путем аминирования или переаминирования пировиноградная кислота, являющаяся продуктом распада углеводов, может превратиться в аминокислоту -аланин. Кроме того, пировиноградная кислота в результате дальнейших превращений дает щавелевоуксусную (СООН—СН2—СО—СООН) и a-кетоглютаровую (СООН—СН2—СН2—СО—СООН) кислоты, из которых путем реакции аминирования и переаминирования соответственно образуются аспарагиновая и глютаминовая аминокислоты.
углеводы в животном организме могут синтезироваться из продуктов окисления белков. Углеводы образуются из тех аминокислот, которые при своем дезаминировании превращаются в кетокислоты.
СВЯЗЬ МЕЖДУ ОБМЕНОМ УГЛЕВОДОВ И ЖИРОВ
Единство в обмене углеводов и жиров доказывается возникновением общих промежуточных продуктов распада. При распаде углеводов образуется пировиноградная кислота, а из нее -активная уксусная кислота -ацетил-КоА, который может быть использован в синтезе жирных кислот. Последние при своем распаде дают ацетил-КоА. Для синтеза нейтрального жира необходим кроме жирных кислот и глицерин. Глицерин также может синтезироваться из продуктов распада углеводов, а именно, из фосфоглицеринового альдегида и фосфодиоксиацетона. И наоборот, при распаде глицерина могут образовываться фосфотриозы.
СВЯЗЬ МЕЖДУ ОБМЕНОМ БЕЛКОВ И ЖИРОВ
Многие заменимые аминокислоты могут синтезироваться из промежуточных продуктов расщепления жиров. Возникающий при распаде жирных кислот цетил-КоА вступает в конденсацию с щавелевоуксусной кислотой и через цикл трикарбоновых кислот приводит к образованию a-кетоглютаровой кислоты. Кетоглютаровая кислота в результате аминирования или переаминирования переходит в глютаминовую. Глицерин, входящий в состав нейтральногo жира, окисляется в глицериновую кислоту и в дальнейшем превращается в пировиноградную, а последняя используется для синтеза заменимых аминокислот.
Использование белков для синтеза жира осуществляется через образование ацетил-КоА.
Далее ацетил-КоА может быть использован для синтеза жирных кислот. Глицерин образуется лишь за счет тех аминокислот, которые способны превращаться в пировиноградную кислоту. 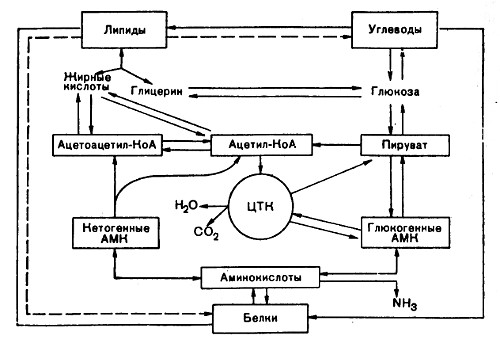
| 47. | Биохимия регуляций. Основные принципы и значение. Иерархия регуляторных систем. Классификация межклеточных регуляторов. Центральная регуляция эндокринной системы: роль либеринов, статинов и тропинов. |
Интеграция – это объединение элементов системы в единое целое.
Координация (соподчинение) – это подчинение менее важных элементов системы более важным элементам. Интеграция и координация – это две стороны процесса регуляции.
Различают:
1. Внутриклеточную регуляцию (ауторегуляцию).
2. Дистантную регуляцию (межкеточную






