Первичная структура белков.
Аминокислоты – амфотерные соединения, соединяющиеся друг с другом в молекуле белка с помощью пептидных связей.
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей 
по отношению друг к другу пептидные группы располагаются под углом.
Линейную последовательность аминокислотных остатков в полипептидной цепи называют «первичная структура белка
Видовая специфичность белков
Индивидуальность белковых молекул определяется порядком чередования АК в белке. Однако многие белки, выполняя одну и ту же функцию, несколько отличаются по строению у разных представителей одного и того же вида. Примером могут служить белки групп крови у человека. Такое разнообразие белков обусловливает индивидуальную специфичность организмов.
Наследственные изменения первичной структуры. Полиморфизм белков
п ервичная структура белков, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению структуры синтезируемого белка. Если изменение последовательности аАКносит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. это полиморфизм белков. примерами полиморфизма: гемоглобин человека(эмбриональный, фетальный, и А гемоглобин взрослого человека
Наследственные протеинопатии: серповидно-клеточная анемия, другие примеры.
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате,а значит и в белках
анемию с обнаружением в его крови, похожих на полумесяц, эритроцитов. Заболевание получило название «серповидно-клеточной анемии, оно вызвано изменением первичной структуры НЬА.
В молекуле гемоглобина S мутантными оказались 2 β-цепи, в которых глутамат, в положении 6 была заменена валином, содержащим гидрофобный радикал. «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию.
Семейная гиперхолестеринемия - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, и ЛПНП а также ранним возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором
2. Конформация белковых молекул (вторичная и третичная структуры)
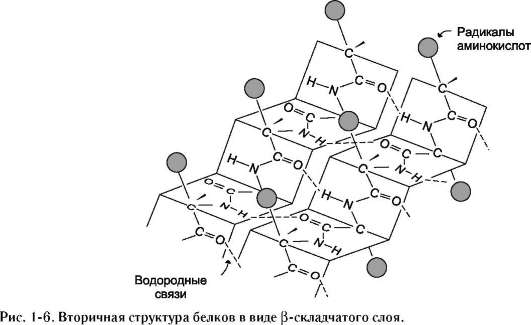
Вторичная структура белка – это способ укладки полипептидной цепи, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.  В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
α-Спираль является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп.
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя (