колоколообразной кривой с максимумом при оптимальном рН.
Принципы определения активности ферментов:
по скорости исчезновения субстрата;
по скорости накопления продуктов реакции.
За единицу активности любого фермента принимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту.
2) В системе СИ активность выражают в каталах: (1кат.=1 моль/с)
Удельная активность=мкм/мин.мг белка.
В энзимологии активность фермента выражают в единицах (U) на 1 л
| 5 Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств. |
участок фермента в котором происходит специфическое связываение субстрата и его превращение в продукт, называется активным центром.
у сложных ферм.в состав акт.центра входит кофактор.
по теории фишера ключ замок по теории кошланда рука перчатка
В свою очередь в активном центре выделяют два участка:
1) якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, 2) каталитический – непосредственно отвечает за осуществление реакции.
этапы:
1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Типы ферментативных реакций: 1. Тип "пинг-понг" – фермент взаимодействует с субстратом А, отбирая у него химические группы. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. перенос аминогрупп от аминокислот на кетокислоты - трансаминирование. 2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента. 3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Ингибитор - вещество, вызывающее специфичное снижение активности фермента.
два направления ингибирования:
1. по прочности связывания с ингибитором обратимым и необратимым.
2. по отношению ингибитора к активному центру фермента конкурентное и неконкурент
При н еобратимом ингибировании происходит связывание или разрушение функциональных групп Ф.модификации подвергается активный центр. Бывают: а)Специфические (блокируют определенные группы активного центра:
б) Неспецифические.являются ферментными ядами:
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента слабыми нековалентными связями, активность фермента постепенно восстанавливается. Пр.: прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре
Конкурентный ингибитор похож на субстрат фермента. он соперничает с субстратом за активный центр. ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой
Неконкурентное ингибирование связано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. (аллостерич или токсины)
ингибиторы протеаз (контрикал, гордокс) при панкреатитах – когда происходит активирование трипсина в протоках и клетках поджелудочной железы.
Аллопуринол – ингибитор ксантиноксидазы,, требуется для снижения образования мочевой кислоты (подагра)
Ингибитор карбоангидразы (ацетазол-амид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, и горной болезни.
| 6. Регуляция действия ферментов: аллостерические механизмы, химическая (ковалентная) модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов. |
Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
1. изменением количества молекул фермента;
2.доступностью молекул субстрата и кофермента;
3.изменением каталитической активности молекулы фермента.
Метаболический путь — ряд последовательных превращений вещества в организме
5. Аллостерическая регуляция. Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными.
Аллостерический центр – центр регуляции активности фермента Присоедин регулятора к алостерич центру приводит к изменению конформации фермента и активного центра.
Аллостерические ферменты обычно стоят в начале метаболических путей, Поэтому они часто называются ключевыми ферментами. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
-при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
-при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии.
-для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот).
6. Белок-белковое взаимодействие в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.пример аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
7. Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще фосфорная кислота, реже метильные и ацетильные группы. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
| 7. Роль ферментов в метаболизме. Многообразие ферментов. Понятие о классификации. Наследственные первичные энзимопатии: фенилкетонурия, алкаптонурия. Другие примеры наследственных энзимопатий. Вторичные энзимопатии. Значение ферментов в медицине. |
метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма.
Выделяют 6 классов ферментов:
I класс – Оксидоредуктазы овр. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота).
II класс – Трансферазы переноса различных групп от одного субстрата (донор) к другому (акцептор. Коферментами являются пиридоксальфосфат, коэнзим А, метилкобаламин.
трансферазы– киназы перенос фосфата от АТФ на субстрат (моносахариды, белки и др),
III класс – Гидролазы разрыв внутримолекулярных связей в субстрате путем присоединения элементов Н2О.например, пепсин, трипсин. Коферменты отсутствуют.
1. Эстеразы – гидролиз сложноэфирных связей. 2. Липазы – гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты.
IV класс – Лиазы разрыв С-О, С-С, C-N и других связей Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Коферментами служат пиридоксальфосфат, тиаминдифосфат,
V класс – Изомеразы изомерные превращения в пределах одной молекулы.коферментам относятся пиридоксальфосфат,глутатион
VI класс – Лигазы присоединение друг к другу двух молекул с использованием энергии АТФ. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты.
энзимопатологии – состояния, связанные с патологическим изменением активности ферментов.
По характеру нарушения выделяют первичные и вторичные энзимопатии.
Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности,
фенилкетонурия связана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект.
подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.
Алкаптонурия - нарушено окисление гомогентизиновой кислоты в тканях (катаболизм тирозина). много гомогентизиновой кислоты и выведение её с мочой. при О2 гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон, моча черная.
галактоземия, недостаточность лактазы и сахаразы.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак.Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий.
ингибиторы протеаз (контрикал, гордокс) при панкреатитах – состояниях, когда происходит активирование трипсина в протоках и клетках поджелудочной железы
Аллопуринол – ингибитор ксантиноксидазы,, требуется для снижения образования мочевой кислоты (подагра)
Понятие о катаболизме и анаболизме и их взаимосвязи. Эндоргонические и экзергонические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии (этапы катаболизма).
Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. состоит из катаболизма и анаболизма
Катаболизм - процесс расщепления органических молекул до конечных продуктов- СО2, Н2О и мочевина. Реакции сопровождаются выделением энергии (экзергонические реакции). Весь катаболизм условно подразделяется на три этапа:
I этап. Специфический. Происходит в кишечнике или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии,она рассеивается в виде тепла.
II этап. Специфический. Вещества, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) или другие. Локализация – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13%т.е. запасается в виде АТФ.
III этап. Общий, неспецефический. в митохондриях. Ацетил-SКоА включается в реакции цтк и окисляется до со2. водород соединяется с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате "окислительного фосфорилирования" образуется вода и АТФ. Часть в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
. Эндергонические и экзергонические реакции
часть внутренней энергии(Е) которая используется для совершения полезной работы-свободная энергия(G), а изменение свободной энергии системы ΔG.
Направление химической реакции определяется значением изменения свободной энергии ΔG. Если эта величина отрица-тельна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоничес-кими. Если при этом абсолютное значение AG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если AG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эн-дергоническими.
Существует четыре способа передачи электронов от одной молекулы к другой.
1. Прямой перенос электронов. Например, окислительно-восстановительная пара может передавать свои электроны паре

2. Перенос в составе атомов водорода. Напомним, что атом водорода состоит из протона и электрона В этом случае общее уравнение имеет вид
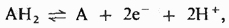
А- акцептор водорода, а вместе они составляют сопряженную окислительно-восстановительную пару, способную восстанавливать акцептор электронов В путем переноса атомов водорода

3. Перенос электронов от донора к акцептору в форме гидрид-иона несущего два электрона, как это имеет место в случае NAD-зависимых дегидрогеназ
4. Перенос путем прямого взаимодействия органического восстановителя с кислородом, приводящего к образованию продукта, в котором содержится ковалентно связанный кислород. Примером такой реакции служит окисление углеводорода до спирта

| Важной особенностью биологического окисления является то, что оно протекает под действием определённых ферментов(оксидоредуктаз). | ||
| 9. Оксидоредуктазы. Классификация. Характеристика подклассов. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм. Важнейшие субстраты НАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы: сукцинатдегидрогеназа и ацилКоА-дегидрогеназа. | ||
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы –дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.






