
СООН-СО-СН2-СН2-СО-СООН- кетоглутарат.
СООН-СН(NH2)-CH2-CH2-CO-COOH глутамат
СН3-СН(NH2)-СООН аланин
COOH-CH2-CH(NH2)-COOH аспартат
СН3СОСООН, пируват
(HO2C-C(O)-CH2-CO2H) оксолацетат
Непрямое дезаминирование, необходимо потому что Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию.
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD+).
Можно выделить 4 стадии процесса:
• трансаминирование с α-кетоглутаратом, образование глутамата;
• трансаминирование глутамата с оксалоаце-татом (фермент АСТ), образование аспар-тата;
• реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
• гидролитическое дезаминирование АМФ. Перенос аминогруппы от аспартата и синтез
| 32. | Образование и пути использования аммиака. Биосинтез мочевины: последовательность реакций, регуляция. Гипераммониемия. |
Источники аммиака и пути его обезвреживания
Основные источники аммиака:
1.неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
2.окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
3.дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
4.катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
5.жизнедеятельность бактерий толстого кишечника,
6.распад пуриновых и пиримидиновых оснований – во всех тканях.
. Содержание аммиака в крови в норме 25-40 мкмоль/л.
- используется на восстановительное аминирование (имеет небольшоезначение);
- используется на образование амидов (аспарагина и глутамина), которые поступают в кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы соответственно расщепляются до глутамата или аспартата и аммиака. В печени аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в виде аммонийных солей с мочой.
- в мышцах аммиак используется на образование аланина, который в печени превращается в пируват, используемый в ГНГ для синтеза глюкозы. Образовавшаяся глюкоза поступает в кровь и переносится в мышцы, где превращается в пируват в ходе гликолиза. существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата: синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком.
ОРНИТИНОВЫЙ цикл 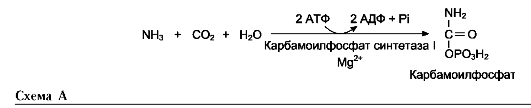

Далее фермент аргининосукцинатлиаза (арги-ниносукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина
Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. 
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращении
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3РО4) + АМФ + Н4Р2О7
Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой.
Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
Гипераммониемия сопровождается появлением следующих симптомов:
• тошнота, повторяющаяся рвота;
• головокружение, судороги;
• потеря сознания, отёк мозга (в тяжёлых случаях);
• отставание умственного развития (при хронической врождённой форме).
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион
| 33. | Обмен фенилаланина и тирозина. Наследственные нарушения обмена фенилаланина и тирозина. Значение серина, глицина и метионина. |
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина.
Метаболизм фенилаланина
Основное количество фенилаланина расходуется по 2 путям:
• включается в белки;
• превращается в тирозин. Превращение фенилаланина в тирозин прежде
Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в
синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и катаболизируется до СО2 и Н2О.
Начинать слева с фенилаланина! Диктовать обе таблицы полностью


Метионин
-удаляет из печени избытки жира благодаря спосоности отдавать метил группу
-способствует синтезу холина
-участвует в синтезе адреналина креатина
-обезвреживает токсичные продукты-способствует снижению содержания холестерина в крови
| 34. | Синтез креатина: последовательность реакций, значение креатинфосфата. Физиологическая креатинурия. Значение креатинкиназы и креатинина в диагностике. |
Креатин - это небелковое азотсодержащее соединение, в образовании которого участвуют печень и почки. Процесс начинается в почках, где из глицина и аргинина образуются гликоциамин (гуанидиноацетат) и орнитин. Орнитин используется в синтезе мочевины. Гликоциамин поступает в кровь и переносится в печень, где он метилируется при участии S-аденозилметионина, превращаясь в креатин, который поступает в мышцы. Когда мышца находится в состоянии покоя, креатин под действием креатинкиназы и при участии АТФ превращается в креатинфосфат - запасной макроэрг. При мышечном сокращении фосфат с креатинфосфата переносится под действием креатинкиназы на АДФ с образованием АТФ.

Креатинурия — повышенное выделение с мочой креатина (см.). Патологическая креатинурия наблюдается при поражениях мышц и состояниях, сопровождающихся повышенным распадом белка: голодании, ожогах, острых лихорадочных заболеваниях, диабете, гипертиреозе. Физиологическая креатинурия может наблюдаться у детей и у женщин в период беременности.
Активность креатинкиназы значительно увеличена при всех типах мышечной дистрофии. Высокие значения активности фермента в сыворотке наблюдаются при вирусных миозитах, полимиозитах, инфаркте
1. Острые или хронические нарушения функции почек любой этиологии (заболевание собственно почек, нарушение перфузии почек, обтурация мочевых путей).
2. Акромегалия и гигантизм.
3. Гипертиреоз.
4. Мясная диета.
Снижение значений.
1. Пониженная мышечная масса тела.
2. Беременность.
| 35. | Нуклеозиды, нуклеотиды и нуклеиновые кислоты, строение, значение. Отличия ДНК и РНК. Нуклеопротеиды. Переваривание нуклеопротеидов. |
Нуклеозиды — это гликозиламины, содержащие азотистое основание, связанное с сахаром (рибозой или дезоксирибозой). Нуклеозиды выполняют только метаболическую функцию, входят в состав нуклеотидов
Нуклеоти́ды— фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Мономерные единицы из которых состоит ДНК и РНК. Свободные нуклеотиды, в частности АТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах. Эту картинку объясни

Нуклеиновые кислоты — высокомолекулярные соединения со строго определенной линейной последовательностью мононуклеотидов, носители генетической информации обо всех белках. 2 типа нуклеиновых кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК). пуриновые - а (А), (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Пентозы либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Пентозу соединяет с основанием N-гликозидная связь,
Первичная структура ДНК - порядок чередования дезоксирибонуклеоЗИДмонофосфатов (дНМФ) в полинукпеотидной цепи.
Вторичная структура - Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны. Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются за счёт водородных связей между А и Т (две связи) и между G и С (три связи). Правило Чаргаффа: «число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С)».
Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль.
Первичная структура РНК - порядок чередования рибонуклеоЗИДмонофосфатов (НМФ) в полинуклеотидной цепи. В РНК, как и в ДНК, нук-леотиды связаны между собой 3',5'-фосфодиэфирными связями
Вторичная структура РНК - Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C.
Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, В цитоплазме клеток присутствуют 3 типа рибонуклеиновых кислот - транспортные РНК (тРНК), матричные РНК (мРНК) и рибосомальные РНК (рРНК). Они различаются по первичной структуре, молекулярной масс, по функциональной активности.
Отличия РНК и ДНК.. 2)Моносахарид (пентоза) в РНК представлен рибозой, в ДНК дезоксирибозой. 3)Азотистые основания в РНК- аденин, урацил, гуанин, цитозин; в ДНК- аденин, Тимин, гуанин, цитозин. 4)Первичная структура РНК нестабильна, в отличии от ДНК, т.к. имеет гидроксильную группу у 2`- углеводного атома рибозы.
Переваривание нуклеопротеидов. Нуклеиновый компонент отделяется от белка в кислой среде желудка. Катаболизм нуклеиновых кислот начинается с гидролиза 3',5'-фосфодиэфирной связи под действием ферментов нуклеаз. 1. ДНКазы - расщепляют ДНК. 2. РНКазы - расщепляют РНК.
Бывают эндонуклеазы (расщепляют внутренние 3'5'-фосфодиэфирные связи) и экзонуклеазы (отщепляют концевые мононуклеотиды). Встречается 2 типа экзонуклеаз: 3'-экзонуклеазы - отщепляют мононуклеотид с 3'-конца молекулы, и 5'-экзонуклеазы - отщепляют 5'-концевой мононуклеоти
Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, могут быть утилизированы во II-м этапе ГМФ-пути. Азотистые основания также подвергаются дальнейшему катаболизму, но по-разному, в зависимости от их типа - пуриновых (аденина, гуанина) или пиримидиновых (тимина, цитозина и урацила).
| 36. | Катаболизм пуриновых и пиримидиновых оснований. Гиперурикемия. Подагра. |
продукт катаболизма пуриновых нуклеотидов - мочевая кислота. Её образование идёт путём гидролитического отщепления фосфатного остатка от нуклеотидов с помощью нуклеотидаз или фосфатаз







