И твёрдого тела
Поверхность жидкости под действием сил поверхностного натяжения стремится принять такую форму, чтобы иметь минимальную площадь.
 , где
, где
 – поверхностное натяжение (коэффициент поверхностного натяжения) Н/м;
– поверхностное натяжение (коэффициент поверхностного натяжения) Н/м;
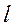 – длина границы свободной поверхности жидкости (поверхности жидкости, граничащей с газовой фазой).
– длина границы свободной поверхности жидкости (поверхности жидкости, граничащей с газовой фазой).
Поверхностное натяжение представляет собой силу, действующую на единицу длины контура, ограничивающего участок поверхности раздела, и направленную касательно к поверхности по внутренней нормали к контуру.
Элементарная работа, совершаемая силами поверхностного натяжения
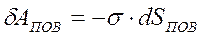 , где
, где
 – изменение площади свободной поверхности жидкости.
– изменение площади свободной поверхности жидкости.
Видно, что поверхностное натяжение численно равно работе, которую необходимо затратить при обратимом изотермическом процессе для увеличения площади поверхности жидкости на единицу. Указанная работа затрачивается на приращение свободной поверхностной энергии жидкости.
Поверхностное натяжение численно равно удельной (приходящейся на единицу площади) свободной поверхностной энергии:
 , Дж/м2.
, Дж/м2.
В природе силы действуют так, чтобы привести систему в состояние с наименьшей потенциальной энергией. Поэтому поверхность раздела сред стремиться уменьшится. Например, капля жидкости в свободном состоянии принимает шарообразную форму.
Если граничат друг с другом сразу три фазы: твёрдая, жидкая и газообразная, то вся система принимает конфигурацию, соответствующую минимуму суммарной энергии.
 Плоскость, касательная к поверхности жидкости у её края, образует с поверхностью твёрдого тела некоторый угол
Плоскость, касательная к поверхности жидкости у её края, образует с поверхностью твёрдого тела некоторый угол  , называемый краевым углом. Этот угол зависит только от поверхностных натяжений на границах раздела соприкасающихся сред.
, называемый краевым углом. Этот угол зависит только от поверхностных натяжений на границах раздела соприкасающихся сред.
 , где
, где
 – поверхностное натяжение на границе раздела твёрдой и газовой фаз;
– поверхностное натяжение на границе раздела твёрдой и газовой фаз;
 – поверхностное натяжение на границе раздела жидкости и газа;
– поверхностное натяжение на границе раздела жидкости и газа;
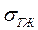 – поверхностное натяжение на границе раздела твёрдой и жидкой фаз.
– поверхностное натяжение на границе раздела твёрдой и жидкой фаз.
Если  (притяжение между молекулами твёрдого тела больше, чем между молекулами жидкости), то краевой угол острый (
(притяжение между молекулами твёрдого тела больше, чем между молекулами жидкости), то краевой угол острый ( ). Это случай смачивания твёрдой поверхности жидкостью. Жидкость в сосуде имеет вогнутый мениск (вода в стеклянном сосуде). Полному смачиванию соответствует угол
). Это случай смачивания твёрдой поверхности жидкостью. Жидкость в сосуде имеет вогнутый мениск (вода в стеклянном сосуде). Полному смачиванию соответствует угол  .
.
Если 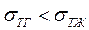 то угол
то угол  тупой (
тупой ( ).Это случай несмачивания твёрдой стенки жидкостью. Жидкость в сосуде имеет выпуклый мениск (ртуть в стеклянном сосуде).
).Это случай несмачивания твёрдой стенки жидкостью. Жидкость в сосуде имеет выпуклый мениск (ртуть в стеклянном сосуде).
 Капли жидкости на горизонтальной поверхности также имеют различную форму.
Капли жидкости на горизонтальной поверхности также имеют различную форму.
Явление смачивания (или несмачивания) твёрдого тела жидкостью приводит к появлению капиллярного эффекта.
Капилляром называют тонкую трубку радиуса r, вставленную в сосуд с жидкостью. Если жидкость смачивает стенки капилляра, то давление внутри жидкости уменьшается по сравнению с внешним и она поднимается внутри капилляра. Если жидкость не смачивает стенки капилляра, то уровень жидкости понижается.

Высота подъёма жидкости в капилляре определяется выражением
 .
.
Дополнительное давление  , создаваемое повер-хностью жидкости определяют по формуле Лапласа для поверхностного натяжения
, создаваемое повер-хностью жидкости определяют по формуле Лапласа для поверхностного натяжения
 , где
, где
 – радиус сферической поверхности жидкости.
– радиус сферической поверхности жидкости.
Диаграммы состояния
Диаграммой состояния называют диаграмму, построенную в переменных р и Т и изображающую кривые равновесия при фазовых переходах данного вещества.
Рассмотрим тройную термодинамическую систему (лёд, вода и пар). Для такой системы существуют совершенно определённые значения давления р тр и температуры Т тр , при которых три фазы могут существовать одновременно.

Точку на диаграмме состояния, соответствующую этим значениям давления и температуры, называют тройной. В этой точке встречаются кривая плавления 1, разделяющая твёрдую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, кривая возгонки 3, разделяющая твёрдую и газообразную фазы.
Точки, в которых могли бы одновременно существовать более трёх фаз, не реализуемы.
Для многих веществ характерны метастабильные состояния, при которых одна фаза существует в области температур и давлений другой фазы (переохлаждённый пар в области жидкой фазы и перегретая жидкость в области газообразной фазы).
 Если изобразить в р-V координатах изотерму двухфазной системы жидкость–газ то её горизонтальный участок будет соответствовать фазовому переходу вещества. Слева от него лежит изотерма газовой фазы, а слева – жидкой.
Если изобразить в р-V координатах изотерму двухфазной системы жидкость–газ то её горизонтальный участок будет соответствовать фазовому переходу вещества. Слева от него лежит изотерма газовой фазы, а слева – жидкой.
С повышением температуры плотность насыщенного пара возрастает и при некоторой температуре становится равной плотности жидкости. В точке К поверхностное натяжение обращается в нуль и исчезает различие между жидкой и газообразной фазами. Состояние, характеризуемое определённым набором значений температуры Т кр, давления р кр и объёма V кр называют критическим.






