При рассмотрении основного уравнения МКТ принималось, что молекулы имеют различные скорости теплового движения. Если даже предположить, что в какой-то момент времени скорости всех молекул одинаковы по модулю и различны только по направлению, то соударения между молекулами приведут к изменению их скоростей и нарушению равенства скоростей по модулю.
 Закон распределения по скоростям теплового движения молекул газа, находящегося в состоянии термодинамического равновесия, впервые был найден Максвеллом и называется распределением Максвелла.
Закон распределения по скоростям теплового движения молекул газа, находящегося в состоянии термодинамического равновесия, впервые был найден Максвеллом и называется распределением Максвелла.
Для получения этого распределения вводится трёхмерное пространство скоростей, в котором по взаимно ортогональным осям координат отложены компоненты 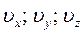 скоростей молекул.
скоростей молекул.
Пусть dN – число молекул в единице объёма газа, модули скоростей которых заключены в пределах от υ до (υ +dυ).
Очевидно, что концы векторов скоростей этих молекул должны лежать в пространстве скоростей внутри шарового слоя, имеющего объём
 .
.
При тепловом движении из-за его беспорядочности все направления скоростей молекул равновероятны. Поэтому число  должно быть пропорционально как числу
должно быть пропорционально как числу 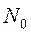 молекул в единице объёма газа, так и объёму
молекул в единице объёма газа, так и объёму  шарового слоя и ещё должно зависеть от модуля скорости
шарового слоя и ещё должно зависеть от модуля скорости  , как какая-то функция
, как какая-то функция  . Таким образом
. Таким образом
 , где
, где
 .
.
Функция  представляет собой долю молекул, модули скоростей которых находятся в шаровом слое единичной толщины, а произведение
представляет собой долю молекул, модули скоростей которых находятся в шаровом слое единичной толщины, а произведение

есть вероятность того, что модуль скорости молекулы заключён между  и
и 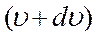 .
.
Ф ункция  называется функцией распределения молекул газа по модулям их скоростей.
называется функцией распределения молекул газа по модулям их скоростей.
Из физического смысла функции  следует, что
следует, что
 .
.
Сложные расчёты показали, что
 .
.
 Вся площадь, ограниченная кривой
Вся площадь, ограниченная кривой 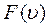 и осью абсцисс, равна единице.
и осью абсцисс, равна единице.
Кривая 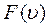 описывает распределение молекул по модулям скоростей.
описывает распределение молекул по модулям скоростей.
Используя выражение для 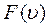 можно записать закон распределения молекул по скоростям (закон Максвелла)
можно записать закон распределения молекул по скоростям (закон Максвелла)
 .
.
Из этого закона можно определить так называемую наиболее вероятную скорость  соответствующую максимуму на графике
соответствующую максимуму на графике 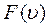 :
:
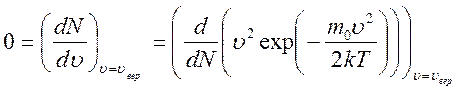 .
.
Решение этого уравнения даёт:
 .
.
Закон распределения молекул по скоростям позволяет вычислить и среднюю арифметическую скорость <υ> поступательного движения молекул идеального газа. Для этого необходимо долю молекул  , обладающих некоторой скоростью υ, умножить на эту скорость и проинтегрировать по всем скоростям от 0 до
, обладающих некоторой скоростью υ, умножить на эту скорость и проинтегрировать по всем скоростям от 0 до 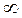 , учитывая, что
, учитывая, что  :
:
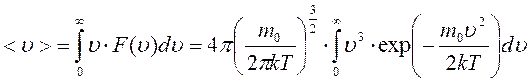 .
.
В результате интегрирования получаем:
 .
.

С увеличением температуры (Т 3 > T 2 > T 1) максимум функции F (υ) смещается в сторону больших скоростей. При этом доля молекул, обладающих малыми скоростями, уменьшается, а доля молекул с большими скоростями увеличивается. Площадь под всеми тремя кривыми остаётся равной единице.
Аналогично закону распределения молекул по скоростям можно найти закон распределения молекул идеального газа по кинетическим энергиям их теплового движения. Это распределение устанавливает долю  молекул, кинетическая энергия которых
молекул, кинетическая энергия которых 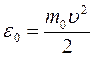 заключена в интервале от
заключена в интервале от  до
до  . Чтобы получить такое распределение нужно в законе Максвелла перейти от скорости
. Чтобы получить такое распределение нужно в законе Максвелла перейти от скорости  к энергии
к энергии  по соотношениям
по соотношениям  и
и 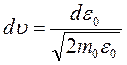 .
.
В результате получаем
 .
.
Введём обозначение  , где
, где
 – функция распределения молекул идеального газа по кинетическим энергиям.
– функция распределения молекул идеального газа по кинетическим энергиям.
По аналогии со средней скоростью найдём среднюю кинетическую энергию поступательного движения молекулы идеального газа:
 .
.
Таким образом  , что и следовало ожидать.
, что и следовало ожидать.
Прямые измерения скоростей теплового движения молекул были впервые выполнены в 1920 г. Штерном в опытах с молекулярными пучками спустя 60 лет после опубликования закона Максвелла.
В качестве исследуемого газа были взяты пары серебра, которое испарялось в вакууме с поверхности платиновой проволоки, нагреваемой электрическим током..
 На пути атомов серебра ставился цилиндрический экран радиусом
На пути атомов серебра ставился цилиндрический экран радиусом  с узкой щелью. Атомы серебра, пролетевшие сквозь щель, осаждались на стенке второго цилиндра радиуса
с узкой щелью. Атомы серебра, пролетевшие сквозь щель, осаждались на стенке второго цилиндра радиуса  , образуя узкую полоску
, образуя узкую полоску  . Если весь прибор вращать вокруг оси, совпадающей с платиновой проволокой, то атомы серебра попадут на стенки цилиндра
. Если весь прибор вращать вокруг оси, совпадающей с платиновой проволокой, то атомы серебра попадут на стенки цилиндра  в новое место
в новое место  .
.
По смещению полоски и известной угловой скорости вращения прибора можно было вычислить скорость движения атомов серебра
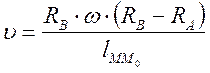 , где
, где 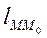 – длина дуги
– длина дуги  .
.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по МКТ.
Зависимость толщины слоя серебра от места конденсации атомов пропорциональна зависимости атомов в этом месте от их скорости.
Опыт Штерна хорошо согласовался с распределением молекул по скоростям Максвелла.
Барометрическая формула
Молекулы любого газа, как и любые материальные точки всегда находятся в поле тяготения Земли. Если бы не было теплового движения молекул атмосферного воздуха, то все они упали бы на Землю. Если бы не было тяготения, то атмосферный воздух рассеялся бы по всей Вселенной.
Для определения закона изменения давления идеального газа с высотой в однородном поле тяготения будем считать, что газ находится в состоянии термодинамического равновесия, так, что его температура Т всюду одинакова. Выделим на высоте y = h столб газа высотой dy и площадью основания S.
Давление газа на нижнее основание столба равно р, а на верхнее основание – (р +dp). С учётом гидростатического давления ρgdy столба газа получаем
 или
или  .
.
Так как  , то
, то 
 и
и
 .
.
Обозначив давление у поверхности Земли – р 0 получаем после интегрирования

Два последних выражения называют барометрическими формулами, позволяющими определить высоту над поверхностью Земли по показаниям барометра.
Так как  , то
, то  .
.
Если учесть, что  – потенциальная энергия молекулы в однородном поле тяготения вблизи поверхности Земли (при условии, что на поверхности Земли
– потенциальная энергия молекулы в однородном поле тяготения вблизи поверхности Земли (при условии, что на поверхности Земли 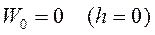 ) то можно записать
) то можно записать

Эта формула является математическим выражением весьма общего и важного закона – Закона Больцмана для распределения частиц во внешнем потенциальном поле независимо от его физической природы.
Объединив распределения Максвелла и Больцмана получают Закон Максвелла-Больцмана, согласно которому число молекул, компоненты скорости которых лежат в пределах от  до
до  , а координаты – в пределах от
, а координаты – в пределах от 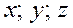 до
до  равно
равно
 , где
, где
 – нормировочный множитель;
– нормировочный множитель;
 и
и 
Равновесные флуктуации
Флуктуациями называют случайные отклонения значений какого-либо параметра термодинамической системы от его среднего значения. Возникают флуктуации вследствие хаотического теплового движения частиц макросистемы (броуновского движения).
Пусть равновесное состояние макросистемы характеризуется некоторым параметром х, среднее значение которого равно < x >. Тогда флуктуации этого параметра определятся как отклонение его значений от среднего:
Δ х = х – < x >.
Средним квадратом флуктуации параметра х называют величину:
 .
.
Средней квадратичной флуктуацией называют величину  .
.
Для количественной оценке флуктуаций используют среднюю квадратичную относительную флуктуацию  .
.
Для всех термодинамических параметров (давление, температура, объём, внутренняя энергия, энтропия) средние квадратичные относительные флуктуации (или просто относительные флуктуации) обратно пропорциональны корню из числа N частиц в системе:
 .
.
Коэффициент пропорциональности для равновесных состояний имеет значение порядка единицы.






