Рассмотрим еще раз типичные реакции нейтрализации между щелочью и кислотой при помощи структурных формул:
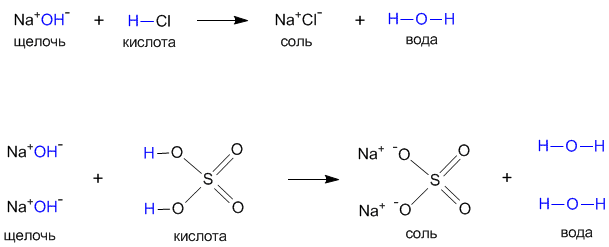
Такая схема наглядно показывает различие между кислотами и основаниями: кислоты склонны отщеплять атомы водорода, а основания – гидрокси-группы. В реакцию нейтрализации с кислотами вступают любые основания, а не обязательно только щелочи.
Разные основания имеют разную способность отщеплять гидрокси-группы, поэтому их, подобно кислотам, подразделяют на сильные и слабые основания (таблица 4.5). Сильные основания в водных растворах склонны легко отдавать свои гидрокси-группы, а слабые – нет.
Таблица 4.5. Классификация оснований по силе.
| Сильные основания | Слабые основания |
| NaOH гидроксид натрия (едкий натр) | Mg(OH)2 гидроксид магния |
| KOH гидроксид калия (едкое кали) | Fe(OH)2 гидроксид железа (II) |
| LiOH гидроксид лития | Zn(OH)2 гидроксид цинка |
| Ba(OH)2 гидроксид бария | NH4OH гидроксид аммония |
| Ca(OH)2 гидроксид кальция (гашеная известь) | Fe(OH)3 гидроксид железа (III) |
| и т.д. (большинство гидроксидов металлов) |
Не следует путать силу основания и его растворимость. Например, гидроксид кальция сильное основание, хотя его растворимость в воде не велика. В данном случае сильным основанием (щелочью) мы называем ту часть гидроксида кальция, которая растворена в воде.
Сила основания важна в реакциях со слабыми кислотами. Слабое основание и слабая кислота реагируют лишь в незначительной степени. Напротив, сильное основание легче реагирует с любой кислотой независимо от её силы.
| 2 NH4OH | + | H2S | = | (NH4)2S | + | 2 H2O |
| слабое основание | слабая кислота | реакция протекает лишь в незначительной степени (мало продуктов реакции) | ||||
| 2 NaOH | + | H2S | = | Na2S | + | 2 H2O |
| сильное основание | слабая кислота | продуктов реакции больше |
Еще одно важное химическое свойство оснований – способность разлагаться при нагревании на воду и основной оксид.
Cu(OH)2 = CuO + H2O (при нагревании)
2 Fe(OH)3 = Fe2O3 + 3 H2O (при нагревании)
Растворы щелочей окрашивают индикаторы: лакмус – в синий цвет, фенолфталеин – в малиновый цвет. Индикатор метиловый оранжевый (или метилоранж) в растворах щелочей имеет желтый цвет.
Амфотерные основания.
Гидроксид цинка Zn(OH)2 является малорастворимым основанием. Его можно получить, действуя щелочью на какую-нибудь растворимую соль цинка – при этом Zn(OH)2 выпадает в осадок:
ZnCl2 + 2 NaOH = Zn(OH)2 + 2 NaCl
Подобно всем другим основаниям, осадок гидроксида цинка легко растворяется при добавлении какой-нибудь кислоты:
Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O
Если же вместо кислоты к осадку гидроксида цинка добавить избыток щелочи, то он также растворяется, чего не происходит с другими гидроксидами. Почему Zn(OH)2 растворяется в щелочи?
Это явление объясняется тем, что в присутствии избытка сильного основания гидроксид цинка способен отдавать атомы водорода, подобно кислоте:
| Zn(OH)2 | + | 2 NaOH | = | Na2ZnO2 | + | 2 H2O |
| гидроксид цинка | щелочь | соль | вода | |||
| H2ZnO2 | + | 2 NaOH | = | Na2ZnO2 | + | 2 H2O |
| цинковая кислота | щелочь | соль | вода |
Происходит реакция нейтрализации наподобие той, которая могла бы произойти между NaOH и кислотой. Эта кислота (цинковая кислота H2ZnO2) и гидроксид цинка Zn(OH)2 являются одним и тем же соединением! Сокращенная (но не структурная) формула этого соединения может быть записана двумя способами:
Zn(OH)2 или H2ZnO2 – это две сокращенные формулы;
H–O–Zn–O–H единственная структурная формула.
Поскольку прочность связей Н–О и O–Zn сравнимы между собой, гидроксид цинка способен быть как основанием в присутствии кислоты, так и кислотой – в присутствии основания:
| H2SO4 | 2 NaOH | |||
| 2 H2O + ZnSO4 | = | Zn(OH)2 = H2ZnO2 | = | Na2ZnO2 + 2 H2O |
| реагирует как основание | реагирует как кислота |
Данное свойство гидроксидов называется амфотерностью.






