Она может образоваться двумя способами: по обменному механизму и донорно-акцепторному (см. далее).
В зависимости от характера распределения электронной плотности молекулы могут быть полярными и неполярными. Если в молекуле каждое электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов, то такая связь называется неполярной (H2, Cl2, O2, N2). Если же соединение состоит из атомов различных элементов и общее электронное облако смещено в сторону одного из атомов, то такая связь считается полярной (NH3, CH4). В полярных молекулах общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов.
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Взаимное притяжение полярных молекул и упрочнение связи между ними указывает на то, что вещества, образованные такими молекулами, имеют более высокие температуры плавления и кипения. Жидкости, состоящие из полярных молекул, способствуют электростатической диссоциации растворенных в них веществ.
Следует отметить, что изо всех известных типов химической связи наибольшее внимание заслуживает ковалентная связь, которая в зависимости от способа перекрывания атомных орбиталей (АО) может образовывать (сигма), (пи) и (дельта)- связи.

В качестве первого примера рассмотрим образование молекулы водорода Н2 в виде схемы (1):


В качестве второго примера рассмотрим описание молекулы аммиака NН3, в состав которой, наряду с тремя атомами водорода, входит атом азота, у которого валентность совпадает с числом неспаренных валентных электронов (схема 2):

 |
Напомним, что представленный выше способ получил название обменного механизма образования ковалентной связи, когда каждый атом предоставляет на связь по одному неспаренному электрону. Однако в методе ВС нет ограничений, налагаемых на «происхождение» общей электронной пары между атомами. Возможен и иной, донорно - акцепторный механизм образования ковалентной связи, когда один из партнёров предоставляет для её образования не один электрон, а готовую пару электронов (неподелённую электронную пару НЭП), а второй – только свободную орбиталь (3):
В рассмотренном примере атом В является донором электронной пары, а атом А – акцептором.
Примером вещества (атома) с НЭП является представленный на схеме 2 атом азота в молекуле аммиака. Это позволяет ему участвовать в образовании ещё одной ковалентной связи в качестве донора электронной пары.
 |
В качестве атома-акцептора может служить, например, положительный ион водорода Н+, вообще лишённый электронов. Его незаполненная 1s-орбиталь (свободная АО) показывается следующим образом (4):
 |
Поэтому между молекулой аммиака NH3 и ионом водорода Н+ возможно взаимодействие по донорно-акцепторному механизму; НЭП атома азота становится общей для двух атомов, возникает ковалентная связь, в результате чего образуется катион аммония NH4+ (5):
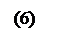 | |||
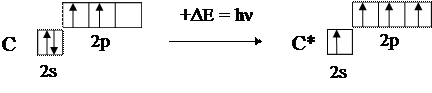 | |||
Рассмотрим классический пример – образование молекулы метана СН4. В нормальном состоянии атом углерода, как показано на схеме (6), содержит только два неспаренных электрона, тогда как их требуется четыре. Процесс перехода атомов в возбуждённое состояние обычно отражают следующей схемой, в которой возбуждённое состояние отмечается звёздочкой у символа химического элемента:
В возбуждённом состоянии атом углерода имеет во внешнем слое необходимые четыре неспаренных электрона, что позволяет показать образование молекулы СН4 следующим образом:
 |
Из представленной схемы (7) видно, что валентные возможности атома углерода на этом исчерпаны.
Для описания образования химической связи существует несколько методов. Наиболее часто применяются два: метод валентных связей и метод молекулярных орбиталей.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
В основе метода валентных связей (МВС) лежит принцип образования гибридных молекулярных орбиталей.
Теория гибридизации валентных орбиталей по методу валентных связей (ВС) дает представление о пространственной конфигурации молекул и комплексных ионов. Согласно этому представлению химические связи образуются за счет перекрывания гибридных (видоизмененных) атомных орбиталей, которые приведены все к одному виду – вытянутые в одном направлении от ядра. В этом случае достигается максимальное перекрывание электронных облаков, а, следовательно, и химическая связь, образовавшаяся с участием электрона гибридной орбитали должна быть прочной.
Такая деформация электронных облаков требует затраты энергии, однако эти затраты компенсируются образованием более прочных химических связей. Тип гибридизации определяется числом атомных орбиталей участвующих в химической связи.
В гибридизации может принимать участие разное число АО разного типа. Обычно от 2 до 6. Рассмотрим наиболее типичные случаи.
sp-гибридизация имеет место при участии двух орбиталей: одной s-
и одной р- атомных орбиталей. При этом в соответствии с условиями гибридизации должны образоваться две равноценные и симметрично расположенные в пространстве, как это представлено на рис. 7, sp-гибридные орбитали.
 |
 |
Рассмотрим образование гидрида бериллия ВеН2. В нормальном состоянии атом бериллия (схема 8) не содержит неспаренных электронов, оба его валентных 2s-электрона спарены и не могут участвовать в образовании сразу двух ковалентных связей. Для этого требуется переход атома Ве в возбуждённое состояние (схема 9).
 |
В возбуждённом состоянии атом бериллия имеет во внешнем слое два неспаренных электрона, что позволяет показать образование молекулы типа ВеХ2 следующим образом:
В случае образования отдельных молекул типа ВеХ2 они должны иметь линейную форму (рис.3.4.) и одинаковую прочность связей.
 |
sp2-гибридизация имеет место при участии трёх орбиталей: одной s- и двух р-орбиталей. При этом образуются три равноценные и симметричные sp2 - гибридные орбитали, которые располагаются в одной плоскости с валентными углами 120º (рис.3.4.).
Для удобства в качестве примера рассмотрим соединение бора в виде ВН3. Поскольку в нормальном состоянии атом бора содержит только один неспаренный электрон вместо необходимых трёх, то необходимо перевести атом бора в возбуждённое состояние (схема 10).
 |
 |
Исходя из представленной схемы (10), делается вывод, что при образовании молекул типа ВХ3 имеет место sp2-гибридизация, поэтому они будут иметь форму правильного треугольника (рис.3.5.) и все связи В–Х будут равноценны.
При sp3-гибридизации требуется участие одной s- и трёх р-орбиталей. В этом случае образуются четыре одинаковых sp3-ГО. Поскольку три р -орбитали располагаются в пространстве, то и расположение ГО будет пространственным, направленным в силу симметрии к вершинам соответствующей правильной объёмной фигуры – тетраэдра.
Такой тип гибридизации имеет место, например, в возбуждённом атоме углерода при образовании молекулы метана СН4 (схемы 6 и 7), имеющей тетраэдрическую конфигурацию (рис.3.6.).
 |
У элементов третьего и более высоких периодов в гибридизации способны участвовать и d-орбитали. Наиболее типичными являются sp3d2 – гибридизация, реже sp2d и sp3d, предполагается существование и более экзотических случаев гибридизации.






