| є | Ёлектрохимический процесс | ≈, ¬ | рЌ |
| 2Ќ2ќ + 2 е Ц = 2ќЌЦ+ Ќ2 | 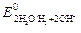 = Ц0,413 = Ц0,413
| ≈7 | |
| 2 | 2Ќ++ 2 е Ц = Ќ2 | 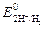 = 0 = 0
| 0 |
| ќ2 + 2Ќ2ќ + 4 е Ц = 4ќЌЦ | 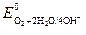 = 0,816 = 0,816
| ≈7 | |
| ќ2 +4Ќ++4 е Ц = 2Ќ2ќ | 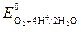 = 1,229 = 1,229
|
¬ соответствии с этими процессами по термодинамической неустойчивости металлы дел€т на п€ть групп.
1. ћеталлы повышенной термодинамической нестабильности (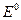 < Ц0,413 ¬): Li, Rb, Cs, Ba, Sr, Ca, Na, Mg, Al, Ti, Zr, Mn,Cr, Zn, Fe. Ёти металлы корродируют даже в нейтральных средах в отсутствие кислорода.
< Ц0,413 ¬): Li, Rb, Cs, Ba, Sr, Ca, Na, Mg, Al, Ti, Zr, Mn,Cr, Zn, Fe. Ёти металлы корродируют даже в нейтральных средах в отсутствие кислорода.
2. ћеталлы термодинамически нестабильные: Cd, In, Tl, Co, Ni, Mo, Pb, W (Ц0,413 ¬ < 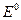 < 0 ¬). ¬одой не окисл€ютс€, но корродируют в кислой среде, а также в нейтральной и кислой средах, содержащих кислород.
< 0 ¬). ¬одой не окисл€ютс€, но корродируют в кислой среде, а также в нейтральной и кислой средах, содержащих кислород.
3. ћеталлы промежуточной термодинамической стабильности (0 ¬ < 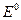 < 0,816 ¬): Bi, Sb, Re, Tc, Cu, Ag, Rh. ”стойчивы в кислых и нейтральных средах в отсутствие кислорода.
< 0,816 ¬): Bi, Sb, Re, Tc, Cu, Ag, Rh. ”стойчивы в кислых и нейтральных средах в отсутствие кислорода.
4. ћеталлы высокой термодинамической стабильности (0,816 ¬ < 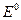 < 1,229 ¬): Hg, Pd, Ir, Pt. ћогут быть окислены в кислых средах при наличии кислорода.
< 1,229 ¬): Hg, Pd, Ir, Pt. ћогут быть окислены в кислых средах при наличии кислорода.
5. ћеталлы полной стабильности (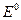 >1,229 ¬): Au. “акие металлы не подвергаютс€ коррозии.
>1,229 ¬): Au. “акие металлы не подвергаютс€ коррозии.
“ак как катодный и анодный процессы проход€т на разных участках поверхности, т. е. разделены пространственно и не мешают друг другу, то электрохимическа€ коррози€ протекает значительно быстрее, чем химическа€.
ћетоды защиты от коррозии
ƒл€ предупреждени€ коррозии используетс€ комплекс противокоррозионных меропри€тий, включающий защиту металлических поверхностей различными методами.
1. ѕротекторна€ защита Ц кзащищаемому изделию присоедин€ют протекторы Ц более активные металлы. «ащита будет действовать до тех пор, пока полностью не растворитс€ анод Ц более электроотрицательный металл (рис. 10.2.1).

2. атодна€ защита Ц защищаемое изделие соедин€ют с отрицательным полюсом источника посто€нного тока, искусственно делают его катодом. ѕоложительный полюс присоедин€ют к другому вспомогательному металлу, который помещают в ту же среду, что и защищаемое изделие.
3. Ћегирование. ѕри легировании в состав сплава вход€т компоненты, вызывающие пассивирование металла.
4. Ќанесение защитных покрытий. Ќеметаллические покрыти€:лаки, краски, масла, полимеры, эмаль, восковые составы или кремнийорганические соединени€.
ћеталлические покрыти€:оцинковка, хромирование, лужение, никелирование, воронение, серебрение, позолота (обычно металлические пленки создают из металлов, образующих прочные оксидные пленки).
–азличают анодные и катодные покрыти€.
јнодные более электроотрицательны по отношению к защищаемому металлу, в электрохимическом р€ду напр€жений сто€т левее защищаемого металла.
атодные более электроположительны по отношению к защищаемому металлу, то есть в электрохимическом р€ду напр€жений металлов сто€т правее защищаемого металла.
5. ”даление растворенного кислорода (примен€етс€ только в ограниченных объемах жидкости).
6. ¬ведение ингибиторов Ц замедлителей коррозии. »нгибиторы создают на поверхности металлов защитную пленку либо уменьшают агрессивность среды. ¬ качестве ингибиторов коррозии примен€ют многие неорганические и органические вещества и разнообразные смеси веществ.
|
|
|
ѕримеры решени€ задач
ѕример 1.
ќпределите термодинамическую возможность газовой коррозии издели€ из углеродистой стали, протекающей по реакции
Fe(т)+ Ќ2O(г) = Feќ(т) + Ќ2(г),
если это изделие эксплуатируетс€ при 700 º— под действием вод€ного пара с относительным давлением p H2O=6 и p H2=1.
–ешение. –еакци€ протекает при условии ∆ G <0. ѕоскольку p H2=1, ∆ G дл€ этой реакциизависит от давлени€ окислител€ Цводы следующим образом:
∆ G= ∆ G 0 Ц RT ln p H2O.
—тандартное значение энергии √иббса при определенном значении температуры можно рассчитать по уравнению
Δ G = Δ Ќ Ц “ Δ S.
ѕусть Δ Ќ иΔ S не завис€т от температуры, тогда они могут быть определены по закону √есса дл€ данной реакции:
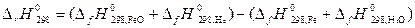 =
=
= (Ц 263,68 +0) Ц (0Ц241,84)= Ц 21,84 кƒж,
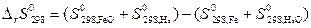 =
=
= (58,79+130,6) Ц (27,15+188,84)= Ц26,61 ƒж/ ,
Δ G 0 = Ц21840 Ц 973(Ц26,61)= 4051,5 ƒж,
∆ G= 4051,5 Ц 8,314 · 973 ln6= Ц10404,36 ƒж.
“аким образом, коррози€ углеродистой стали при 700 º— возможна.
ѕример 2
ак происходит коррози€ цинка, наход€щегос€ в контакте с кадмием в нейтральном и кислом растворах? —оставьте электронные уравнени€ анодного и катодного процессов. аков состав продуктов коррозии?
–ешение. —тандартный потенциал цинка равен (Ц0,763 ¬), кадми€ (Ц0,403 ¬). ѕоэтому цинк будет €вл€тьс€ анодом, а кадмий Ц катодом.
јнодный процесс: Zn0 Ц 2 e Ц= Zn2+;
катодный процесс:
в кислой среде 2H+ + 2 e Ц= H2,
в нейтральной среде O2 + 2H2O + 4 e Ц= 4OHЦ.
ѕоскольку ионы двухвалентного цинка при взаимодействии с гидроксогруппой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.






