n эк (О2)(анод) = n эк (Н2)(катод) или  ,
,
Откуда
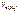 =
= 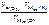 =
=  = 1120 см3,
= 1120 см3,
 = 11200 см3/моль.
= 11200 см3/моль.
 = 5600 см3/моль.
= 5600 см3/моль.
На катоде выделилось 1120 см3 водорода.
Ответ: 1120 см3 водорода.
б) AgNO3 = Ag+ + 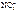 .
.
Схема электролиза:
K(-) A(+) инертный
Ag+ + ē = Ag 
H2O 2H2O – 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: n эк(О2)(анод) = n эк(Ag)(катод) или
 ,
,
Откуда 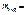
 =
=  = 10,8 г.
= 10,8 г.
где 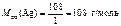 .
.
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
Дано:
Смесь Zn и ZnO
m смеси = 7,27 г
V о( 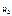 ) = 1,12 л ) = 1,12 л
| Решение
 .
m ZnO = m смеси – m Zn. .
m ZnO = m смеси – m Zn.
|
| ωZnО –? |
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
УРОВЕНЬ В
Определить температуру, при которой возможен карботермический процесс
PbO(к) + C(к) < = > Pb(к) + CO(г).
| Дано: Уравнение реакции | Решение Приведенный процесс будет возможен, когда относительное давление оксида углерода (II) будет равно т.е. Р СО = 1. |
| Т –? |
Поскольку К р = Р СО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения
–2,303 RT lgKp = Δ rH º(298 K) – Δ rS º(298 K).
Так как lgKP = lg1 = 0, то 0 = Δ rН º(298 K)1000 – ТΔ rS º(298 K)
Откуда 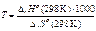 ,
,
где 1000 – коэффициент перевода килоджоулей в джоули.
Δ rH º(298 K) и Δ rS º(298 K) определим по первому следствию из закона Гесса. Подставим табличные данные в уравнение:
PbO(к) + C(к) < = > Pb(к) + CO(г)
Δ fH º(298 K) –219,3 0 0 -110,5
кДж/моль
S º(298 K) 66,1 5,7 64,9 197,5
Дж/моль К ·
Δ rH º(298 K) = –110,5 – (–219,3) = 108,8 кДж,
Δ rS º(298 K) = 197,5 + 64,9 – 5,7 – 66,1 = 190,6 Дж/К.
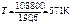 .
.
Ответ: процесс возможен при нагревании с Т =571 К.
1. Вычислить массовую долю оксида цинка в смеси с цинком, если при взаимодействии 7,27 г смеси с водным раствором щелочи выделилось 1,12 л водорода (н.у.).Поскольку водород выделяется только при взаимодействии цинка с водным раствором щелочи, то массу цинка определяем из уравнения реакции:
Zn + 2H2О + 2NaOH = Na2[Zn(OH)4] + H2
Zn – 2e = Zn2+ 1
2H+ + e = H 2
Zn + 2H+ = Zn2+ + 2H
Составляем пропорцию:
65,4 г Zn 22,4 л Н2
mZn 1,12 л Н2,
где МZn = 65,4 г/моль.
m Zn = 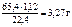 .
.
m ZnО = m смеси – m Zn = 7,27 – 3,27 = 4 г.
 .
.
Ответ:  .
.
Рассчитать константу равновесия в реакции цементации
CuSO4(р-р) + Fe(к) < = > FeSO4(р-р) + Cu(к),
Протекающей при стандартных условиях.
| Дано: Уравнение реакции | Решение Записываем реакцию в ионном виде: |
| Кс –? |
Feo(к) + Cu+2(р-р) + SO 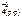 <=> Fe+2(р-р) + SO
<=> Fe+2(р-р) + SO 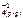 + Cuo(к)
+ Cuo(к)
Полное ионное уравнение.
Cu+2(р-р) + Feo(к) < = > Fe+2(р-р) + Cu0(к) – сокращенное ионное уравнение
НОК ДМ
окис-ль Сu+2 + 2ē = Cu 1 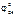 = 0,34 В (см. табл. 11.1)
= 0,34 В (см. табл. 11.1)
восст-ль Fe0 – 2ē = Fe+2 1  = –0,44 В (см. табл. 11.1)
= –0,44 В (см. табл. 11.1)
Cu+2 + Fe0 = Cu0 + Fe+2
ε0 = 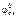 –
–  ; ε0 = 0,34 – (–0,44) = 0,78 В.
; ε0 = 0,34 – (–0,44) = 0,78 В.
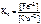 .
.
Так как приведенная реакция является окислительно-восстанови-тельной, то
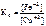 =
= 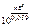 ,
,
где n – НОК.
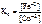 =
= 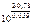 = 1026
= 1026
Высокое значение Кс свидетельствует о прктически полном смещении равновесия вправо.
Ответ: Кс = 1026
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
УРОВЕНЬ В
Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в каждом из соединений
K4[Mo(CN)8], [PtCl4(NH3)2].






