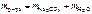 .
.
Тогда
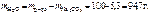
Следовательно,
 ,
,
где 1000 – коэффициент пересчета граммов в килограммы.
Ответ:  моль/кг.
моль/кг.
5. Определить титр раствора вещества, если в 200 см3 раствора содержится 0,1 моль гидроксида калия.
Дано:
V р-ра = 200 cм3

| Решение
Титр раствора вещества определяем по формуле
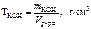 . .
|
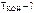
|
Согласно условию задачи  = 0,1 моль,
= 0,1 моль,
откуда m KOH = 0,1· M KOH = 0,1·56 = 5,6 г,
где М КОН – молярная масса гидроксида калия:
М КОН = 39 + 16 + 1 = 56 г/моль.
Следовательно, 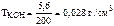 .
.
Ответ:  = 0,028 г/см3.
= 0,028 г/см3.
6. Определить молярную долю растворенного вещества в 3,42 %-м растворе сахарозы (С12Н22О11).
Дано:

| Решение Молярную долю сахарозы в растворе определяем по формуле |
  –? –?
|

 =
= 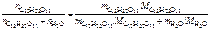 ,
,
где m  и m
и m  – соответственно массы сахарозы и воды;
– соответственно массы сахарозы и воды;
М  и М
и М  – соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
– соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
Массы сахарозы и воды определяем согласно условию задачи (3,42 %-й раствор сахарозы).
Следовательно, в 100 г раствора содержится 3,42 г С12Н22О11,
m  = 100 – 3,42 = 96,58 г.
= 100 – 3,42 = 96,58 г.

 =
=  .
.
Ответ: 
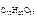 = 0,00186.
= 0,00186.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
УРОВЕНЬ В
Рассчитать изменение стандартных энтальпии и энтропии химической реакции
4HCl(г) + O2(г) = 2Н2О(г) + 2Сl2(г)
| Дано: Уравнения химической реакции | Решение Изменение стандартных энтальпии и энтропии химической реакции рассчитываем на основании первого следствия из закона Гесса: | |||
| D r Ho(298 K) –? D rS o(298 K) –? | ||||
D rH o(298 K) = [2D f Ho(298 K, Н2О(г)) + 2D f Ho(298 K, Cl2(г))] –
– [4D fH o(298 K, НCl(г)) + D fH o(298 K, О2(г))];
D rS o(298 K) = [2 S o(298 K, Н2О(г)) + 2 S o(298 K, Cl2(г))] –
– [4 S o(298 K, НCl(г)) + S o(298 K, О2(г))],
где D rH o(298 K, В) и S o(298 K, В) – стандартные энтальпии образования и энтропии веществ, которые находим из таблицы:
| 4HCl(г) | + О2(г) | = 2Н2О(г) | + 2Сl2(г) | |
| D rH o(298K) кДж/моль | 4(-92,3) | 2(-241,84) | ||
| S o(298 K), Дж/(мольК) | 4(186,8) | 2(188,7) | 2(222,9), |
тогда:
D rH o(298 K) = 2(–241,84) – 4(–92,3) = –114,48 кДж;
∆ rS o(298 K) = (2·188,7 + 2·222,9) – (4·186,8 + 205) = –129 Дж/К.
Ответ: D rH o(298 K) = –114,48 кДж, D rS o(298 K) = –129 Дж/К.
2. Стандартная энтальпия сгорания этилена (С2Н4) равна
–1410,8 кДж/моль. Написать термохимическое уравнение сгорания этилена и вычислить стандартную энтальпию его образования.
| Дано: D flH o(298 K, C2H4(г)) = = –1410,8 кДж/моль | Решение Составляем реакцию сгорания 1 моль этилена: |
| D fH o(298 K, C2H4(г)) –? |
1C2H4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж);
D flH o(298 K) = – 1410,8 кДж/моль.
Стандартной энтальпией сгорания вещества называется тепловой эффект реакции полного сгорания 1 моль органического вещества до СО2(г) и Н2О(ж) при стандартных условиях.
Следовательно, для данной реакции
D flH o(298 K) = D rH o(298 K) = –1410,8 кДж.
Для определения D fH o(298 K, C2H4(г)) используем первое следствие из закона Гесса для этой же реакции:
D rH o(298 K) = 2D fH o(298 K, СО2(г)) + 2D fH o(298K, Н2О(ж)) –
– D fH o(298 K, С2Н4(г)) – 3D fH o(298 K, О2(г)).
Откуда
D fH o(298 K, С2Н4(г)) = 2D fH o(298 K, СО2(г)) +
+ 2D fH o(298K, Н2О(ж)) – D rH o(298K) – 3D fH o(298K, О2(г)).
Значения стандартных энтальпий образования (Н2О(ж) и СО2(г)) берем из таблицы:
D fH o(298 K, С2Н4(г)) = 2(–393,5) +
+ 2(–285,8) – (–1410,8) = 52,2 кДж/моль.
Ответ: D fH o(298 K, С2Н4(г)) = 52,2 кДж/моль.
3. По заданным термохимическим уравнениям рассчитать стандартную энтальпию образования Fe2O3(к) из простых веществ:
Fe(к) +1/2O2(г) = FeO(к), D rH o(298 K, 1) = – 264,8 кДж. (4.1)
4FeO(к) + O2(г) = 2Fe2O3(к), D rH o(298 K, 2) = – 585,2 кДж. (4.2)
| Дано: Термохимические уравнения двух реакций | Решение Стандартная энтальпия образования вещества есть тепловой эффект реакции образования 1 моль Fe2O3(к)из простых веществ при стандартныхусловиях. Запишем |
| D rH o(298 K) искомой реакции |
термохимическое уравнение реакции образования Fe2O3(к) из простых веществ Fe(к) и O2(г):
2Fe(к) + 3/2O2(г) = Fe2O3(к). (4.3)
Из двух реакций (4.1) и (4.2) необходимо получить реакцию (4.3). Для этого складываем термохимические уравнения (4.1) и (4.2), предварительно умножив на 2 стехиометрические коэффициенты реакции (4.1) и разделив на 2 стехиометрические коэффициенты реакции (4.2):
2Fe(к) + O2(г) + 2FeO(к) + ½O2(г) = 2FeO(к) + Fe2O3(к).
После сокращения получаем уравнение реакции (4.3):
2Fe(к) + 3/2O2(г) = Fe2O3(к).
Для определения изменения стандартной энтальпии реакции (4.3) аналогичные математические действия осуществляем с тепловыми эффектами приведенных реакций (4.1) и (4.2):
D rH o(298 K, 3) = 2D rH o(298 K, 1) + ½D rH o(298 K, 2) =
= 2(-264,8) + ½(-585,2) = – 822,2 кДж.
Так как реакция (4.3) соответствует образованию 1 моль Fe2O3 из простых веществ, то
D fH o(298 K, Fe2O3) = – 822,2 кДж/моль.
Ответ: D fH o(298 K, Fe2O3) = – 822,2 кДж/моль.
Дано:
Е ак = 60 кДж/моль а) Т 1 = 320 К,
Т 2 = 360 К б) Т = 298 К,
 = 48кДж/моль = 48кДж/моль
| Решение
а) Из уравнения Аррениуса получаем
 = =  ; ;
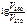 = = 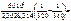 1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда 1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда
 =101,09 = 12,3 раза. =101,09 = 12,3 раза.
|
а)  –?
б) –?
б) 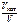 –? –?
|
| Дано: Уравнение реакции, Кр = 1 | Решение
CO2(г) + C(к) <=> 2CO(г),  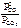 . .
|
| Т –? |






