И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ В
Реакция между веществами А и В описывается уравнением
А(г) + 2В(г) = 2С(г).
Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ с о(А) = 0,4 моль/л, с о(В) = 0,8 моль/л. Вычислить начальную скорость реакции и определить во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
Дано:
Уравнение реакции,
К = 0,1
с  = 0,4 моль/л
с = 0,4 моль/л
с  = 0,8 моль/л
с = 0,8 моль/л
с  уменьшается
на 0,1 моль/л уменьшается
на 0,1 моль/л
| Решение
В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
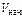 = K· с = K· с  · ·  =
= 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с). =
= 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с).
|
Vнач –?  =? =?
|
Исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции.
1моль А – 2 моль В
0,1 моль А – х моль В
х =  моль.
моль.
Следовательно, уменьшение концентрации вещества А на 0,1 моль/л сопровождается уменьшением концентрации вещества В на 0,2 моль/л, тогда:
V кон = К· с А· 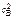 .
.
 = 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).
= 0,1(0,4 – 0,1)(0,8 – 0,2)2 = 0,0108 моль/(л·с).
В связи с уменьшением концентрации реагирующих веществ в ходе реакции скорость реакции уменьшается:
 = 2,37,
= 2,37,
Т.е. скорость реакции уменьшилась в 2,37 раза.
Ответ:  = 0,0256 моль/(л∙с).
= 0,0256 моль/(л∙с).
При уменьшении концентрации вещества А на 0,1 моль/л, скорость реакции уменьшилась в 2,37 раза.
2.Энергия активации некоторой реакции равна 60 кДж/моль. Во сколько раз изменится скорость реакции: а) при повышении температуры от 320 до 360 К? б) если она протекает при 298 К в присутствии катализатора (Е ак (кат)= 48 кДж/моль)?
Б) Зависимость скорости реакции от наличия катализатора выражается уравнением
 =
= 
 2,103,
2,103,
откуда  = 101,03= 127.
= 101,03= 127.
Ответ:
А) при повышении температуры от 320 до 360 К скорость реакции возрастает в 12,3 раза;
Б) в присутствии катализатора скорость реакции возрастает в 127 раз.
3.Используя справочные данные по Δ fH º(298 K) и S º(298 K) веществ, определить температуру, при которой константа равновесия реакции CO2(г) + C(к) <=> 2CO(г) равна единице. Записать выражение для константы равновесия данной реакции.
Твердые вещества в выражение Кр не включаются.
Значения Δ fH º(298 K) и S º (298 K) веществ берем из таблицы. По условию Кр = 1, следовательно, lgKp = 0, тогда
Δ rH °(298 K) – T Δ rS °(298 K) = 0,
T =  ,
,
где 103 – коэффициент пересчета килоджоулей в джоули.
Δ rH º(298 K) = 2Δ fH º(298 K, CO(г)) – [Δ fH º(298 K, CO2(г)) +
+ Δ fH º(298 K, Cк)]
Δ rH º(298 K) = 2(–110,5) – [(–393,5) + 0] = 172,5 кДж.
Δ rS º(298 K) = 2 S º(298 K, CO(г)) – [ S º(298 K, CO2(г)) + S º(298 K, C(k))] =
= 2·197,5 – (213,7 + 5,74) = 175,56 Дж/К.
Т =  = 982,6 K.
= 982,6 K.
Δ rH º(298 K) – T Δ rS º (298 K) = –2,303 RT lgKp
Ответ: Кр = 1 при 982,6 К.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
УРОВЕНЬ В
1. Вычислить температуры кипения и замерзания водного раствора, содержащего 0,1 моль сахарозы ( ) в 500 г раствора.
) в 500 г раствора.
 = 0,52 кг·К/моль,
= 0,52 кг·К/моль,  = 1,86 кг·К/моль.
= 1,86 кг·К/моль.
Дано:
 = 0,1 моль
m р-ра = 500 г = 0,1 моль
m р-ра = 500 г
 = 0,52 кг·к/моль = 0,52 кг·к/моль
 = 1,86 = 1,86
| Решение
t кип р-ра = 100 ºС + ∆ t кип,
t зам р-ра = 0 ºС – ∆ t зам ,
∆tкип =  · cm ( · cm ( ),
∆tзам = ),
∆tзам =  · cm ( · cm (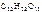 ),
cm ( ),
cm ( ) – моляльность сахарозы в растворе, моль/кг. ) – моляльность сахарозы в растворе, моль/кг.
|
| t кип р-ра –? t зам р-ра –? |
cm ( ) =
) =  ,
,
где  – количество растворенной сахарозы,
– количество растворенной сахарозы,
Моль.
 =
=  , г;
, г;
cm ( )
) 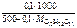
 моль/кг,
моль/кг,
где М  = 342 г/моль
= 342 г/моль
∆ t кип = 0,52 ∙ 0,21 = 0,109 ºС;
t кип р-ра = 100 ºС + 0,109 ºС = 100,109 ºС;
∆ t зам = 1,86∙0,21 = 0,391 ºС;
t зам р-ра = 0 ºС – 0,391 ºС = –0,391 ºС.
Ответ: t кип р-ра = 100,109 ºС;
t зам р-ра = – 0,391 ºС.
2. В 100 г воды содержится 2,3 г неэлектролита. Раствор обладает при 25 ºС осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита. Плотность раствора принять равной 1 г/см3.
Дано:
m в = 2,3 г
t = 250C
 = 100 г
π = 618,5 кПа
ρр-ра = 1 г/см3 = 100 г
π = 618,5 кПа
ρр-ра = 1 г/см3
| Решение
π = с в ∙ R ∙ T, кПа.
R = 8,314 л∙кПа/(моль∙К).
с в – молярная концентрация
вещества, моль/л.
V р-ра = m р-ра/ρр-ра =
(m B + m 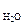 )/ρр-ра , см3.
V р-ра = )/ρр-ра , см3.
V р-ра =  102,3 см3 = 0,102 л. 102,3 см3 = 0,102 л.
|
| М В –? |
с в =  , моль/л,
, моль/л,
где m в – масса растворенного неэлектролита, г;
М в – молярная масса растворенного неэлектролита, г/моль.
π = 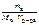 ∙ R ∙ T, кПа;
∙ R ∙ T, кПа;
М в =  = 90,33 г/моль.
= 90,33 г/моль.
Ответ: молярная масса растворенного вещества равна 90,06 г/моль.
3. Определить давление насыщенного пара воды над 1,0 %-м раствором карбамида (CO(NH2)2) при 298 К, если давление насыщенного пара над водой при той же температуре равно 2,34 кПа.
Дано:
 = 1,0 %
Т = 298 К
p o = 2,34 кПа = 1,0 %
Т = 298 К
p o = 2,34 кПа
| Решение
р = р o∙   =
=  , ,
|
| Р –? |
где р – давление насыщенного пара воды над раствором, кПа,
р o – давление насыщенного пара воды, кПа;
 – молярная доля воды;
– молярная доля воды;
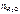 – количество воды, моль;
– количество воды, моль;
 – количество CO(NH2)2, моль;
– количество CO(NH2)2, моль;
 = 60 г/моль,
= 60 г/моль,  = 18 г/моль.
= 18 г/моль.
В 100 г 1 %-го раствора карбамида содержится 1 г карбамида и 99 г воды.
р = 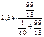 = 2,33 кПа.
= 2,33 кПа.
Ответ: давление насыщенного пара воды над 1 %-м раствором CO(NH2)2 составляет 2,33 кПа.







